

蛋白酶体抑制剂(PI)的发现和应用使多发性骨髓瘤(MM)治疗取得了极大进步,多种联合方案显著改善MM缓解率与存活率,已成为MM治疗基石药物1。但是它们的使用,特别是不可逆PI,与相对频繁的心血管不良反应有关,如心力衰竭(HF)、高血压和缺血性心脏病2。PI在骨髓瘤患者中为何会发生心脏毒性?蛋白酶体抑制与心功能障碍是否存在关联?超声心动图心功能标志物是否具有预测价值?对于这些临床医生特别关注的问题,结合2023年两篇欧洲最新研究进展,今天小编带大家来一起按迹循踪。
1. UPS(泛素-蛋白酶体系统)是心肌细胞生存和死亡的关键调节因素,对于维持正常心脏功能非常重要。
2. 心肌细胞中,抑制蛋白酶体依赖性蛋白质周转可导致蛋白质失衡,泛素化蛋白异常累积引起细胞功能障碍,导致心肌细胞损伤。
3. 以不可逆蛋白酶体抑制剂(如:卡非佐米)为基础的治疗可诱发心脏功能的全面恶化,首先是LA(左心房)重塑和LV(左心室)应变节段功能障碍,然后是LV和右心室(RV)功能障碍。
4. 2023年《欧洲内科医学杂志》报道在4.2年的中位随访中,基线纵向LA应变峰值下降的患者的死亡风险增加1.7倍,HF住院风险增加2.7倍,新发房颤风险增加7倍。
5. 欧洲心脏病学会心脏肿瘤学委员会的立场声明,主张对接受不可逆蛋白酶体抑制剂(如:卡非佐米)的中/高危患者进行超声心动图监测。
UPS对于维持正常心脏功能非常重要
泛素-蛋白酶体系统(UPS)是真核细胞中蛋白质代谢和蛋白质质量控制重要系统,负责70%~90%内源性蛋白质的降解3,在调节许多细胞过程中发挥重要作用,包括正常和病理条件下的细胞周期、免疫反应、细胞凋亡、细胞信号传导和蛋白质周转,以及通过去除受损、氧化和/或错误折叠的蛋白质来控制蛋白质质量4。心肌细胞是非增殖性细胞,与其他组织相比,具有更高的蛋白酶体活性以及更高的蛋白质周转率5。因此,UPS是心肌细胞生存和死亡的关键调节因素,对于维持正常心脏功能非常重要4。UPS功能正常时,可以维持组成肌小节、线粒体和细胞膜所必需的蛋白质的完整性,从而保证正常的心功能3;蛋白酶体功能障碍在心肌缺血、充血性心力衰竭、心肌病等心脏病理过程中起到重要作用4。
抑制蛋白酶体功能可导致心肌细胞损伤与死亡
在骨髓瘤细胞中,蛋白酶体抑制可导致内质网(ER)内不相容调节蛋白快速积累,这种内质网应激最终导致未折叠蛋白反应(UPR),并诱导细胞凋亡级联反应,从而引起MM细胞凋亡。同样,在心肌细胞中,抑制蛋白酶体依赖性蛋白质周转可导致蛋白质失衡,泛素化蛋白异常累积,这些泛素化蛋白相互结合形成蛋白质聚集体,引起细胞功能障碍,导致心肌细胞损伤,最终导致Caspase介导的心肌细胞凋亡和死亡6。
PI心脏毒性引起临床担忧
2022 ESC肿瘤心脏病学指南明确指出:蛋白酶体抑制剂(PI)与多种心脏毒性有关,包括心力衰竭、急性冠脉综合征、心律失常等(图1)7。目前批准的所有3种PI(硼替佐米、卡非佐米和伊沙佐米)都可引起心脏毒性,PI联合疗法治疗MM的研究显示,心脏毒性风险增加,其中卡非佐米联合方案的心脏毒性发生率最高(图2)。
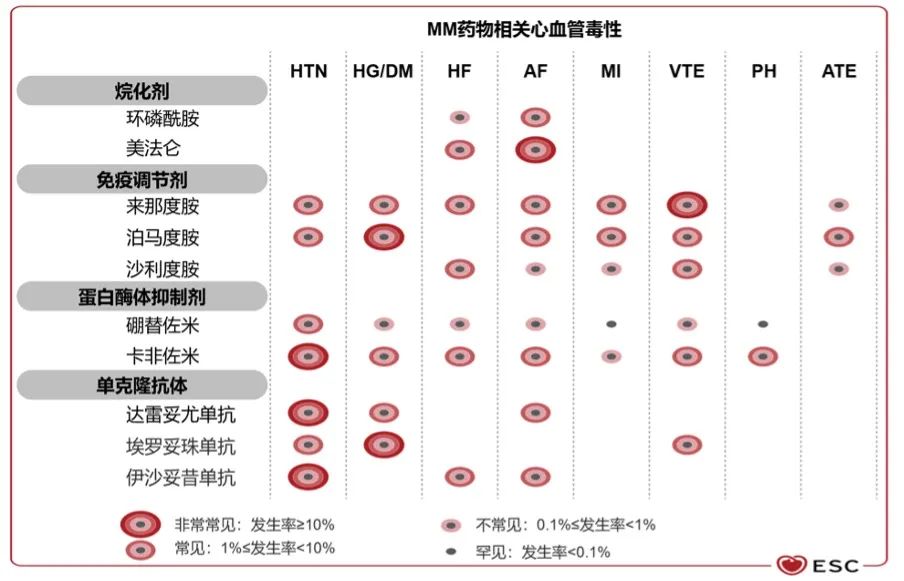
图1 MM药物相关心血管毒性
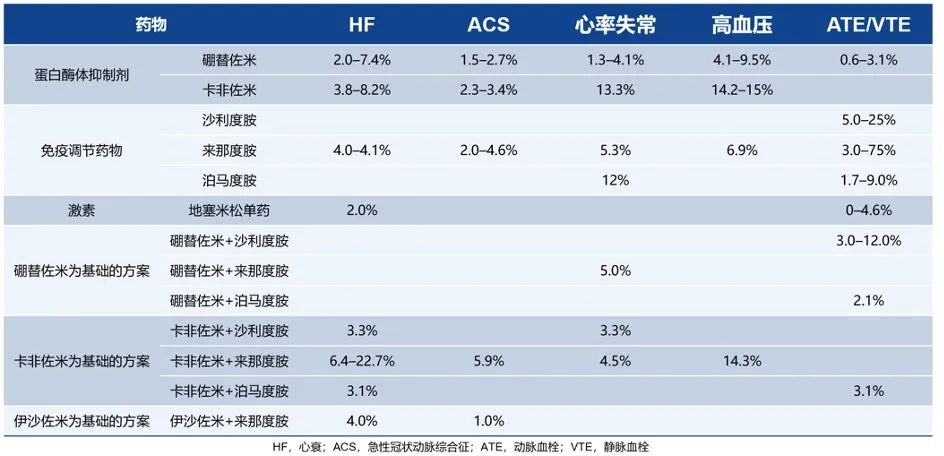
图2 MM常用药物及方案的心血管不良事件发生情况
卡非佐米是一种新型PI,与硼替佐米不同之处在于,卡非佐米与20S蛋白酶体的β5亚基形成不可逆结合,对β5亚基具有更高的选择性,使其具有更大的蛋白酶体抑制作用5。卡非佐米可在超过80%的患者中引起蛋白酶体抑制,与硼替佐米相比,卡非佐米表现出相应疗效的同时也呈现独特的毒性特征,尤其是心脏毒性引起临床关注6。全球Ⅲ期临床试验ENDEAVOUR研究8和ASPIRE研究9均报道,卡非佐米方案显著改善复发/难治性MM患者PFS同时心脏毒性事件率增加。荟萃分析10同样显示,卡非佐米方案组所有级别和高级别心脏毒性发生率高达8.68%、4.92%,均为对照组的2倍,亚组分析中新诊断MM和复发/难治性MM之间全部和严重心脏毒性发生率没有差异 (P值分别为0.38和0.46)(图3)。
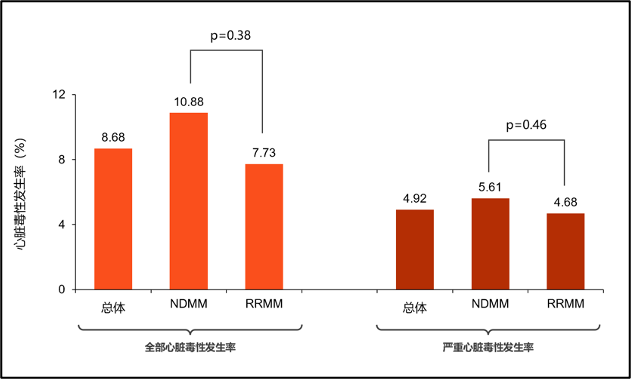
图3 荟萃分析显示卡非佐米治疗相关心脏毒性发生率较高
前瞻性研究:卡非佐米抑制蛋白酶体会影响心脏力学,导致心脏功能的整体恶化
卡非佐米较高的心脏毒性事件引起临床广泛关注与担忧,研究者展开了卡非佐米抑制蛋白酶体活性对心肌功能影响的相关探索,并试图确定超声心动图标志物变化与蛋白酶体活性的关联。2023年4月24日,《欧洲心脏杂志——心血管影像》(Eur Heart J Cardiovasc Imaging,IF:9.130)刊登了一项前瞻性研究2,阐述了MM患者采用卡非佐米联合地塞米松(Kd)治疗后,蛋白酶体抑制对心脏力学的影响,证实了不可逆PI类药物卡非佐米抑制UPS会导致心脏功能的整体恶化。
该项前瞻性研究评估了48例接受卡非佐米治疗的MM患者。所有患者接受Kd方案治疗,于基线、治疗后3个月、治疗后6个月进行超声心动图随访,并检测外周血单核细胞蛋白酶体活性(PrA)。
结果显示,在治疗3个月,研究者观察到早期左心室(LV)节段功能障碍和左房(LA)重构恶化,这种情况持续存在,而且比心脏毒性对照组观察到的更明显。治疗后6个月,左、右心功能进一步减弱(均P<0.05)(图4)。这些变化与血压、内皮功能、炎症和心脏损伤程度无关。PrA(proteasome activity)变化与整体纵向应变(GLS)、节段性LV应变和LA标志物变化相关(均P<0.05)(图4)。
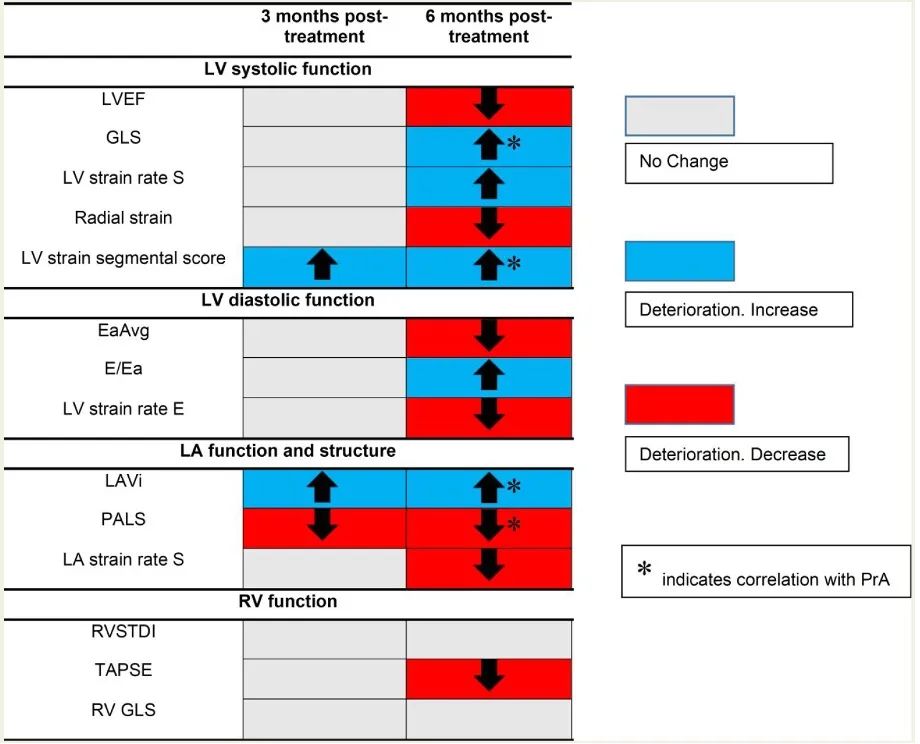
图4 Kd治疗后3个月和6个月时心脏标志物的变化及其与PrA(Proteasome activity)的关系。卡非佐米诱导了心脏功能的整体恶化,其中LA重塑标记物和LV应变节段性评分恶化较早。
在这项前瞻性研究中,研究了卡非佐米对复发/难治性MM患者心脏力学的影响。这项研究提出了几个新的发现:
①以卡非佐米为基础的治疗诱发了心脏功能的全面恶化,首先是LA重塑和LV应变节段功能障碍,然后是LV和右心室(RV)功能障碍;
②观察到的心脏力学变化与血压和内皮功能标志物无关,表明治疗和心脏功能障碍之间有直接联系;
③心脏力学变化与PrA相关,支持UPS抑制与心脏功能障碍的直接联系;
④基线左心房应变率(LASRS)和左心室整体纵向应变(GLS)受损可以预测这些患者新的或恶化的高血压的发生;
⑤相比心脏毒性对照组,对卡非佐米反应的恶化在左心房容积指数(LAVi)方面更为明显,而在GLS方面类似,这表明与其他心脏毒性治疗相比,卡非佐米可能特别影响LA力学。
本研究报告了一系列超声心动图参数的下降,提示Kd的整体恶化效应。这些变化与PrA变化的相关性表明,它们主要归因于卡非佐米诱导的蛋白酶体抑制,而不是Kd治疗的其他成分,如地塞米松。
对于接受卡非佐米治疗的患者,超声心动图监测的临床价值仍在调查之中,证据有限。心力衰竭协会、欧洲心血管成像协会和欧洲心脏病学会心脏肿瘤学委员会的立场声明,主张对接受卡非佐米的中/高危患者进行超声心动图监测,并强烈建议在出现新的心脏体征或症状时及时进行超声心动图检查。
早期的LA指数损伤表明,卡非佐米治疗后对LA应变和应变率的基线测定和随访可能有助于早期发现心脏功能障碍。
MM患者LA应变的预后价值:LA应变恶化降低生存期,增加死亡率、心衰住院率和新发房颤风险
MM患者心脏功能障碍的早期识别可能影响治疗选择和长期预后,已发现左心室整体纵向应变(GLS)可预测MM患者死亡率,因此,研究者对于LA应变是否为MM患者心功能不全标志的预后价值,以及其对心力衰竭(HF)住院和新发房颤(AF)的影响展开进一步调查。
2023年5月20日,《欧洲内科医学杂志》(European Journal of Internal Medicine,IF:7.749)报道了首个在大型MM患者队列中评估LA应变预测价值的研究11,证实LA应变恶化后降低生存期,增加死亡率、心衰住院率和新发房颤风险。
该研究回顾性纳入248例被诊断为MM的患者,这些患者在诊断后一年内进行了超声心动图检查。LVEF<40%、先前有心肌梗死或HF的患者被排除在外。在诊断评估(包括病史和体检、电泳、免疫固定、血清学和骨髓活检)期间,没有出现淀粉样蛋白的临床怀疑。使用TomTec进行斑点跟踪LA应变分析。使用以前发表的数据,定义23%的绝对值作为正常LA应变的最佳临界值。中位随访4.28年。
结果显示,LA应变与MM患者死亡率相关。在LA应变减少≤23%的个体中,中位总生存期为3.8年,在LA应变>23%的个体中,中位总生存期为7年(log-rank检验P=0.0006)(图5)。
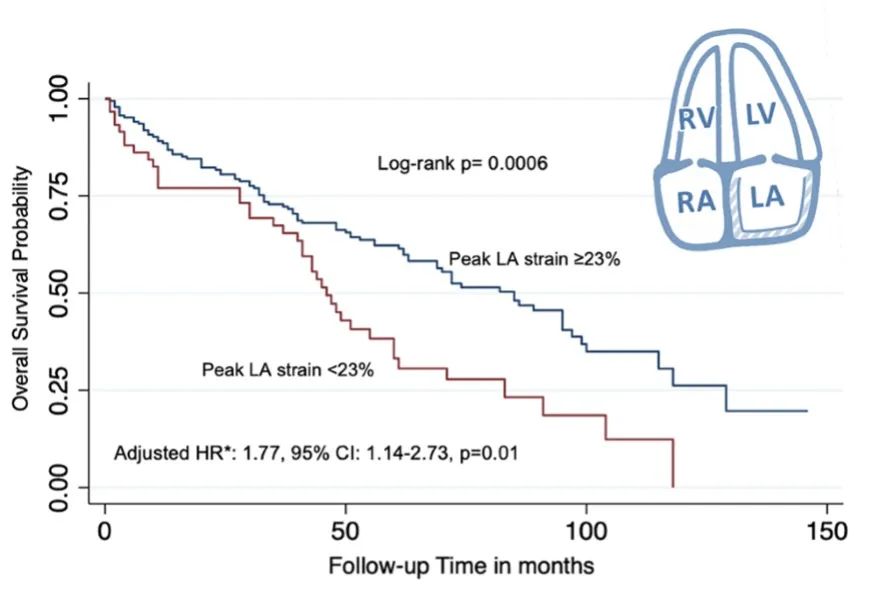
图5 根据LA中位应变峰值的Kaplan-Meier生存曲线
单变量分析中,LA应变≤23%与较高死亡率相关(HR 1.90,95% CI:1.30-2.77,P=0.001)。校正LVEF 40-49%、左室GLS≥-18%、舒张功能障碍、MM化疗、高血压、糖尿病、性别和年龄>65岁等因素后,LA应变≤23%仍与死亡风险独立相关(HR 1.77,95% CI:1.14-2.73,P=0.01)。
logistic回归分析中,LA应变与HF住院和新发AF独立相关(图6)。
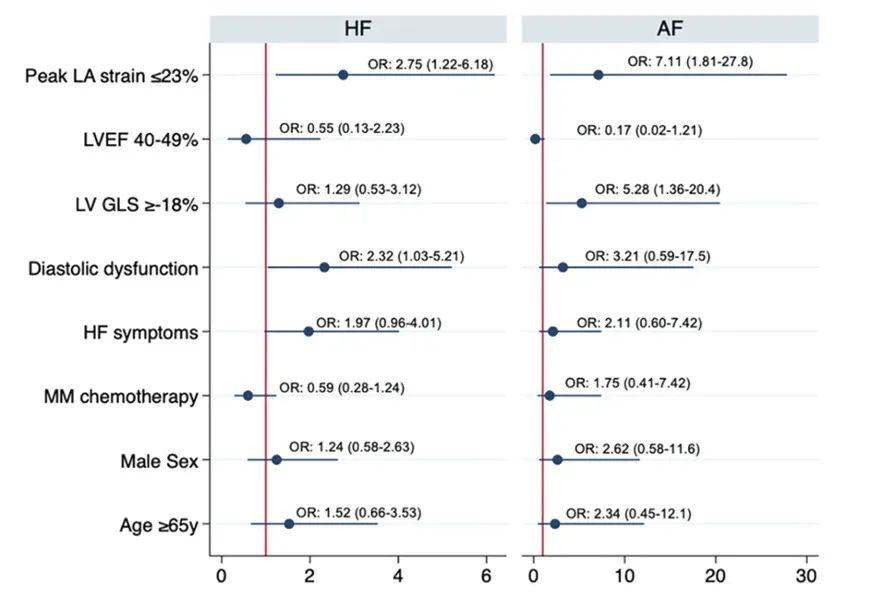
图6 对心衰住院和新发房颤的预测因素进行logistic回归分析
总体χ2评分显示,LA应变≤23%对预测死亡率、HF住院率和新发AF具有明显的增量值(图7)。将LA应变≤23%与LV GLS≥-18%相加,可改善对死亡率(综合分辨力提高0.01,标准误差0.007,P=0.05)和新发房颤的风险分层(综合分辨力提高0.07,标准误差0.02,P=0.001),但对HF住院的风险分层没有改善。
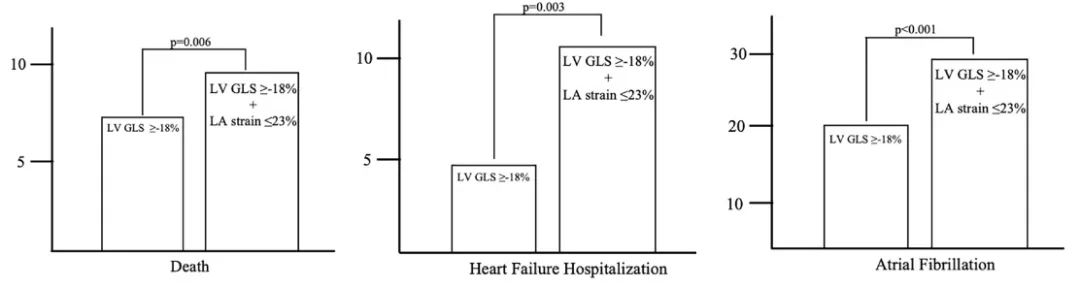
图7 LA应变在LV GLS上的增量值
专家点评
蛋白酶抑制剂(PI)作为多发性骨髓瘤治疗中非常重要的一类药物,在临床中被广泛应用。但是它们的使用,特别是不可逆性PI(如卡非佐米),与相对频繁的心血管不良反应有关,如心力衰竭(HF)、高血压、心律失常及缺血性心脏病等。近年来,PI相关心血管毒性风险也引起了血液及心血管领域专家的重视。
近期欧洲发表的一篇文章阐述了不可逆性PI(如卡非佐米)造成心脏毒性的可能机制:以卡非佐米为基础的治疗诱发了心脏功能的恶化,首先引起左心房重塑和节段性左心室功能障碍,随后导致双心室功能障碍。相较于其它药物导致的心脏毒性,卡非佐米引起的心脏功能恶化在左心房容积指数(LAVi)方面更为明显,而在左心室整体纵向应变(GLS)方面类似,这表明与其他心脏毒性治疗相比,卡非佐米可能特别影响左心房(LA)力学。
而另外一项纳入了248例多发性骨髓瘤的回顾性研究发现,基于斑点追踪的左房应变在MM患者中具有重要的预后价值。在4.2年的中位随访中,基线时纵向LA应变峰值下降的患者的死亡风险增加1.7倍,HF住院风险增加2.7倍,新发房颤风险增加7倍。
这些研究结论也提示未来在使用不可逆蛋白酶体抑制剂(如卡非佐米)治疗多发性骨髓瘤时,需要进行早期评估、密切监测与妥善管理相关心脏毒性风险。而抗肿瘤药物引发心血管毒性的机制和研究也在不断为临床医师提供更安全的用药指导。

张宇辉,主任医师、教授、博士生导师,中国医学科学院阜外医院心力衰竭中心、HFCU主任。国家心血管病专家委员会心力衰竭专业委员会秘书长;中国医师协会心力衰竭专业委员会总干事;国家心血管病中心力衰竭专病医联体和中国心力衰竭质控项目秘书长;中华医学会心血管病分会心力衰竭学组副组长;中国抗癌协会整合肿瘤心脏病学专业委员会常委;JACC: CardioOncology国际编委;《中华心力衰竭与心肌病杂志(中英文)》编辑部主任和副主编;从事心血管内科疾病诊治工作多年,积极推动慢性心衰的规范化诊治,擅长各种心肌病的精准诊断和治疗,以及疑难心肌病、肿瘤性心脏病、淀粉样心肌病、心血管急危重症诊治。负责主持国家自然科学基金青年和面上基金,国家十三五课题子课题。独立或具体负责二十余项国内、国际心衰新药研究和临床协作课题,中国心衰注册研究,国家心血管病中心心力衰竭专病医联体,国家心力衰竭质控等项目。荣获2019“国之名医·青年新锐”荣誉称号。
参考文献
Clephas PRD, Radhoe SP, Boersma E, et al. Efficacy of Pulmonary Artery Pressure Monitoring in Patients with Chronic Heart Failure: A Meta-Analysis of Three Randomized Controlled Trials [published online ahead of print, 2023 May 21]. Eur Heart J. 2023;ehad346. doi:10.1093/eurheartj/ehad346