

研究背景
致心律失常性右室发育不良/心肌病(ARVC)是一种遗传性心肌病,以进行性心肌纤维-脂肪替代为主要特征,以室性心律失常(VAs)和心源性猝死(SCD)为主要临床表现。SCD预防是ARVC患者临床管理主要目标之一,植入式心脏复律除颤器(ICD)是目前临床应用最普遍的干预策略之一。大多数有持续性VA或心脏骤停(SCA)复苏病史的ARVC患者均可从二级预防ICD植入中获益。但对于ICD植入一级预防适应症人群,目前尚未建立有效的风险预测体系。既往小群体研究由于统计能力有限,无法确定此类人群中与VA发生相关的危险因素。为了克服这一局限性,本研究旨在:利用现有临床变量,构建一个适用于ARVC患者持续性VA发生的个体化预测模型;评价新模型相较于现有指南共识在指导预防性ICD植入的临床效能。
研究方法
本研究是一个回顾性、纵向、观察性队列研究。入选528名符合ARVC 2010工作组标准(TFC)且无持续性VAs/SCD病史的ARVC患者。主要研究终点是确诊后首次持续性VA事件。持续性VA事件定义为由SCD、SCA、自发持续性室性心动过速(VT,在≥100 b.p.m.时持续≥30 s或需要电复律的血液动力学不稳定VT)、心室颤动/扑动(VF)或适当的ICD放电构成的复合事件。本研究也记录了首次发作的快速持续性VA(定义为SCD、SCA、VF或VT>250 b.p.m.)、心脏移植、心血管(CV)死亡和全因死亡事件。纳入的变量包括性别、年龄、近期(<6个月)心脏性晕厥、非持续性室速(NSVT)、24小时动态心电图监测的室性早搏(PVC)计数、前壁下壁导联的T波倒置(TWI)、右心室射血分数(RVEF)和左心室射血分数(LVEF)。所有纳入的预测变量皆采集于患者诊断(即TFC诊断前1年至后1年)且未发生主要终点事件时。
研究结果
1. 基线特征
研究入选的528名患者中,男性占比44.7%(n=236),平均年龄为38.2±15.5岁。先证者(n=263,49.8%,家庭中第一个明确诊断ARVC的个体)和家庭成员(n=265, 50.2%)的比例相当。三分之二(n=340, 64.4%)的患者携带有ARVC相关的致病性或可能致病性基因变异(例如突变)。390名(73.8%)患者资料完整,可用于构建临床预测模型,其他临床和人口学特征总结在表1中。
表1 患者的基线临床特征

2. 治疗结局
在中位随访4.83年(2.44–9.33年)期间,146(27.7%)名患者发生终点事件,年事件发生率为5.6%[95%置信区间(CI)4.7–6.6]。图1展示了无首次持续性VA事件的累积生存率。如图所示,整个随访期都有结局事件发生,5年无事件累积生存率为73.6%(95%CI 69.4-78.0%)。最常见的首次持续性VA事件是适当的ICD放电(n=102, 70.0%),其次是自发持续性VT(n=35, 23.9%)、SCA(n=6, 4.1%)和SCD(n=3, 2.0%)。53例(10.0%)患者在随访期间发生了快速持续性VAs(周期<240 ms的VT、SCA或SCD),年事件发生率为1.7%(95%CI 1.3-2.2)。末次随访时18例患者死亡(3.4%),14例患者进行了心脏移植(2.7%)。
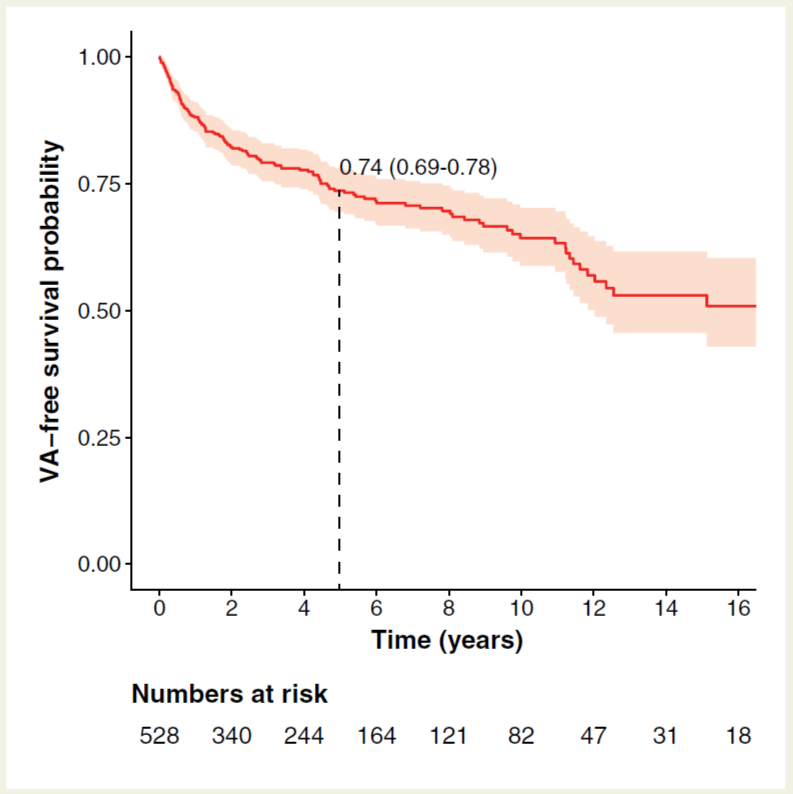
图1 无持续性室性心律失常的累积生存率。图中实线为随访期无持续性VA事件的累积生存率,阴影区域为无事件生存率的95%置信区间(阴影区域)。虚线表示5年累积生存率。
3. 模型构建
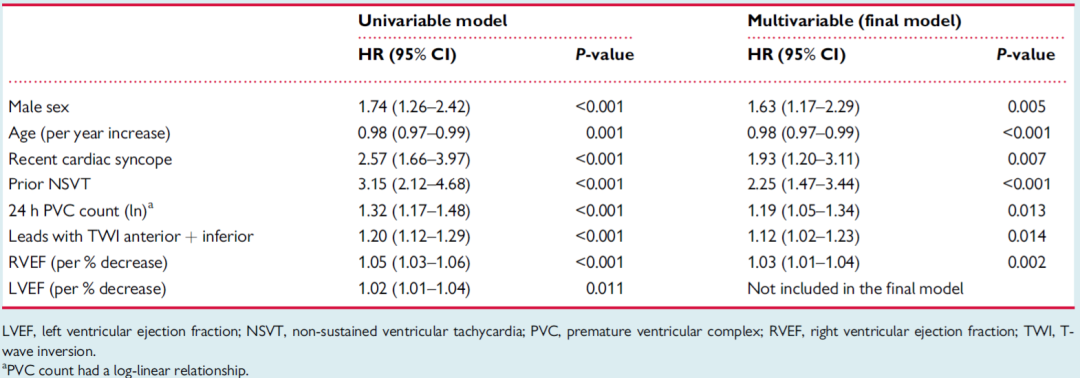
表1显示了有和无持续性VA患者的基线特征,表2总结了风险预测模型的构建。如这些表所示,每个预设的预测因子与主要结局都具有显著(P<0.05)的单变量线性或对数线性关系。因此,将所有预测因子拟合到多变量模型中,采用逐步向后法筛选变量,剔除了LVEF,其他预测因子均纳入最终预测模型。
表2 心律失常风险预测模型
用以下公式计算持续性VA的5年风险:
P ( VA at 5 years ) = 1-0.8396 exp(LP)
其中LP=0.488*性别-0.022*年龄+0.657*近期心脏性晕厥病史+0.811*NSVT病史+0.170*ln(24小时PVC计数)+0.113*前壁下壁导联TWI总和-0.025*RVEF。有关计算单个患者风险的在线应用程序,请访问:www.arvcrisk.com。
4. 模型验证
预测模型的最优校正C指数为0.77(95%CI 0.73-0.81),自举法内部验证显示校准斜率为0.93(95%CI 0.92–0.95),反映了存在一定程度的过拟合。图2为校准图形,显示了预测和观察到的5年风险之间具有良好的总体一致性。
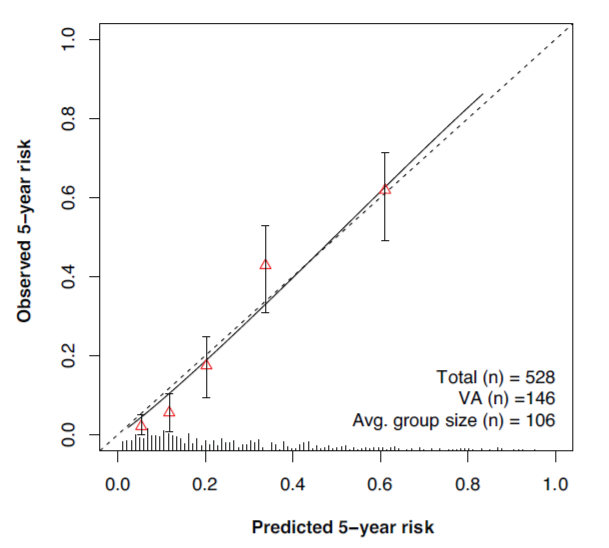
图2 校准图显示主要结局的预测(x轴)和观察(y轴)的5年风险之间的一致性。
5. 临床应用
为了评估模型在临床实践中的效用,进一步探讨了在新模型与现有ITFC共识(即在ITFC I/IIa类适应症患者中植入ICD)中潜在的5年VA风险阈值对ICD植入的影响,见图3。在保护作用相似的前提下,ITFC模型需植入ICD的数量为 355(67.2%),而新构建的预测模型这一数量仅为283 (53.6%),使ICD植入需求量减少了20.3%[(355–283)/355,(P<0.001)]。
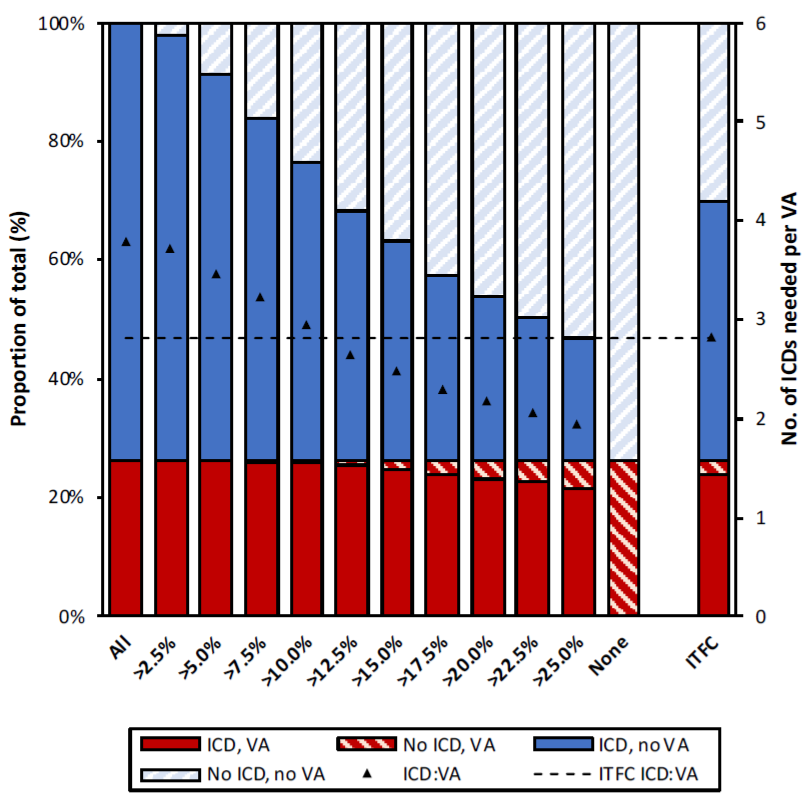
图3 基于模型预测的植入式心脏复律除颤器(ICD)植入阈值相关的患者结局。图中显示了新模型中所有患者中均植入(最左条形)或均不植入(右侧第二条形)植入式心脏复律除颤器的保护效应差异,以及均根据国际工作组共识声明(最右条形)治疗所有患者的保护效应。其余的条形图显示了基于模型计算使用不同的植入式心律转复除颤器放置阈值对VA发生风险的影响。每个条形代表完整队列(n=528),颜色编码代表发生(红色)或不发生(蓝色)持续性室性心律失常以及植入(实色)与不植入(条纹颜色)植入式心脏复律除颤器的患者比例。黑色三角形表示保护一名发生室性心律失常的患者所需植入式心脏复律除颤器的数量,水平虚线表示参考值(即根据国际工作组共识声明进行的治疗)。左y轴表示患者的比例(对应于颜色编码);右y轴表示保护一名患者所需的植入式心脏复律除颤器的数量(对应于黑色三角形)。ICD:VA:保护一名发生室性心律失常患者所需的植入式心脏复律除颤器植入比例。
随后,使用决策曲线分析将模型的临床效应与ITFC算法进行了比较。如图4所示,在整个ICD潜在植入阈值范围内,研究提出的新模型均与临床最高净效益相关,反应了新模型优异的临床应用效能。
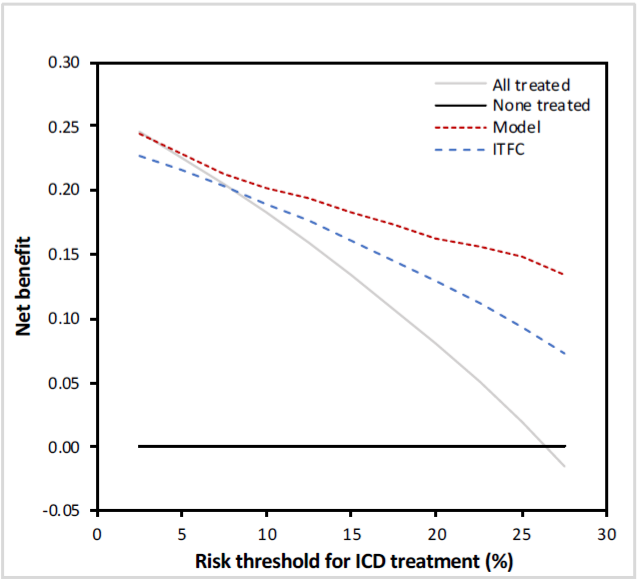
图4 决策曲线分析比较新模型(红色虚线)与国际工作组共识声明算法(蓝色虚线)的临床效用。通过绘制基于5年VA风险(x轴)的一系列潜在的植入式心脏复律除颤器植入阈值的净收益(y轴),来比较两种治疗策略的临床效用。在所有潜在植入阈值范围内,新模型的临床净效益最高(范围从2.5%到27.5%)。
总结与讨论
本研究是迄今为止最大规模的无持续性室速ARVC患者队列,本研究提出了一个新的预测模型,对VA发生风险进行个体化评估。该模型基于现成的临床参数,临床效能优于当前的共识指南,并有可能成为ARVC患者预防性ICD植入的临床决策标准。但本研究患者来自北欧和北美,多为白人且致病变异多位于PKP2,限制了研究结果在其他种族背景或基因型患者中的推广。
参考文献
Cadrin-Tourigny J, Bosman L P, Nozza A, et al. A new prediction model for ventricular arrhythmias in arrhythmogenic right ventricular cardiomyopathy[J]. European heart journal, 2022;, ehac180, https://doi.org/10.1093/eurheartj/ehac180
供稿:田鹏超
责编:翟玫 庄晓峰
审校:张宇辉