

研究背景
肾素-血管紧张素-醛固酮系统抑制剂(RAASi)是射血分数减低的心力衰竭(HFrEF)患者的标准治疗方法,但会增加高钾血症的风险,特别是在老年和合并慢性肾脏病(CKD)和/或糖尿病的患者中。高钾血症,甚至认为存在高钾血症风险,会导致RAASi的使用不佳,特别是盐皮质激素受体拮抗剂(MRA)的使用不佳。Patiromer是一种新型的钾离子(K+)结合剂,在治疗高钾血症方面具有良好的耐受性和有效性。DIAMOND试验旨在评估在因RAASi治疗出现高钾血症或既往有高钾血症的HFrEF患者中,Patiromer是否可以控制K+水平,同时优化RAASi治疗,并改善临床结局。
研究设计
DIAMOND试验是一项多中心、随机、双盲、安慰剂对照的Ⅲb期临床试验。试验筛查了1642例HFrEF患者,这些患者有高钾血症或有与RAASi相关的高钾血症史。符合标准的患者经过12周导入期的优化后,进入治疗期。研究设计和试验流程见图1。
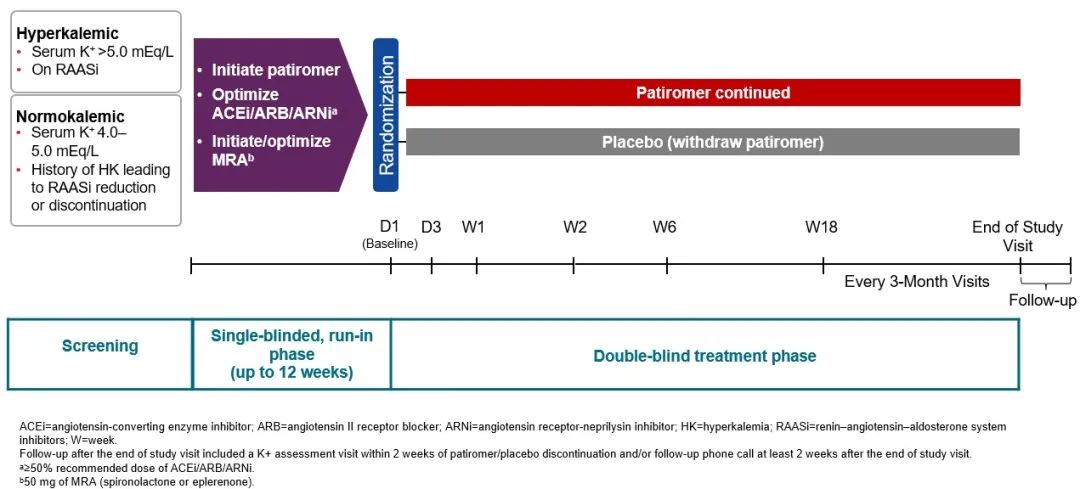
图1A 研究设计
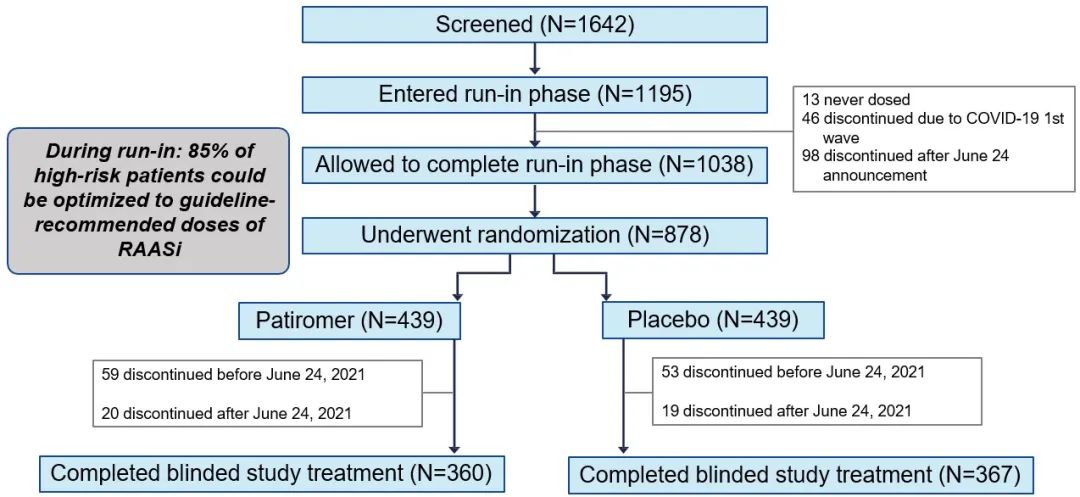
图1B 试验流程
纳入标准:纽约心脏协会(NYHA)心功能II-IV级;左心室射血分数≤40%;使用β受体阻滞剂治疗心力衰竭(心衰)或不能耐受β受体阻滞剂;估算肾小球滤过率(eGFR)≥30 ml/min/1.73 m2;高钾血症:筛查时接受血管紧张素转化酶抑制剂(ACEI)/血管紧张素受体阻断剂(ARB)/血管紧张素脑啡肽酶抑制剂(ARNi)/MRA治疗且血K+>5.0 mEq/L,或者筛查时血钾正常,但一年内接受RAASi治疗时,记录的血K+>5.0 mEq/L,导致随后一种及以上RAASi减量或停用。
排除标准:急性失代偿性心衰;eGFR<30 mL/min/1.73 m2;收缩压(SBP)<90 mmHg或症状性低血压;过去4周内发生过重大心血管(CV)事件。
主要终点事件是Patiromer组和安慰剂组在试验期间血清K+浓度较基线的平均差异。次要终点事件包括高钾血症事件(>5.5 mEq/L)首次发生时间、MRA剂量减少到靶剂量以下(50 mg螺内酯或依普利酮)的时间、研究者报告的高钾血症的不良事件(首次发生和复发)、经高钾血症相关结局(包括CV死亡、CV住院及K+ >6.5 mEq/L、>6.0–6.5 mEq/L和>5.0–6.0 mEq/L的高钾血症事件总数)调整的致死、致残的胜率(win-ratio)以及新的RAASi使用评分的胜率见图2。
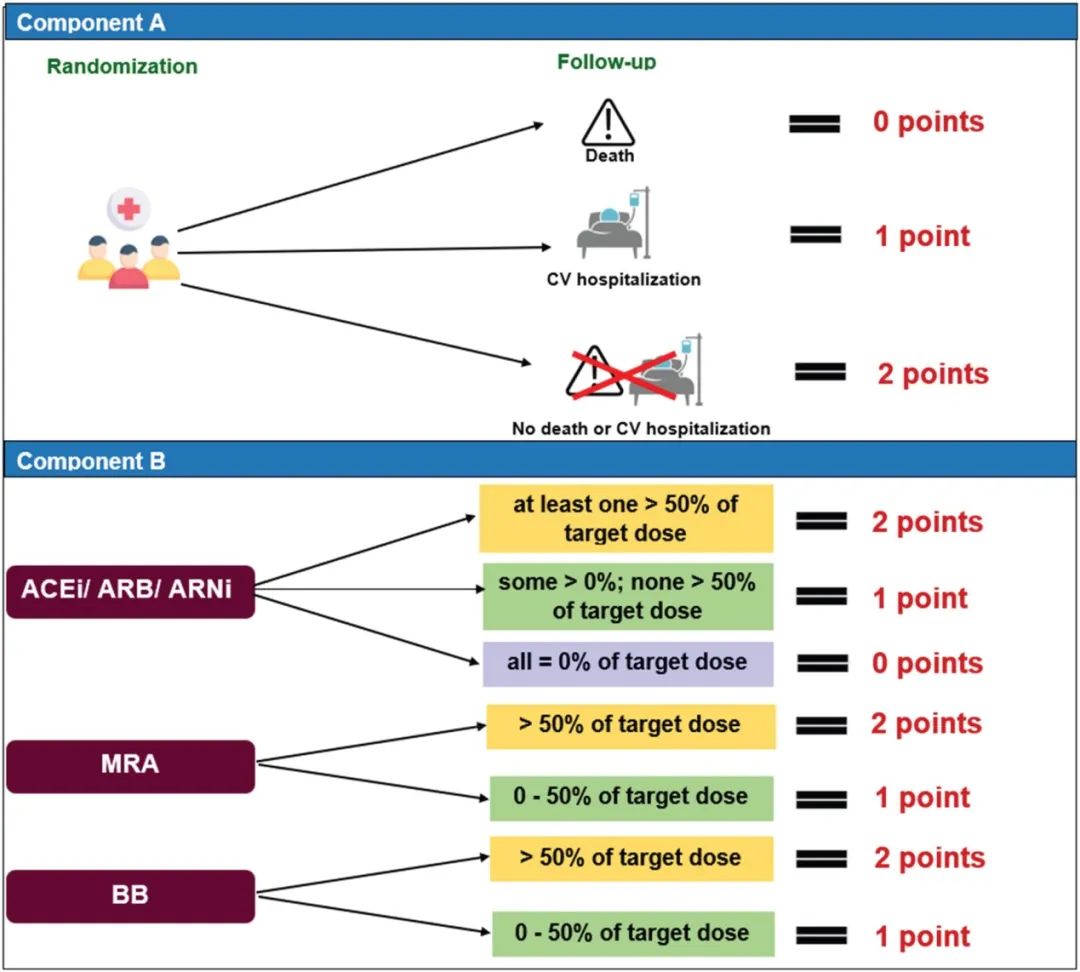
图2 肾素-血管紧张素-醛固酮系统抑制剂使用评分的分层组合
研究结果
研究最终入组878例受试者,以1:1随机分配至Patiromer组和安慰剂组。中位随访时间为27个月。两组基线特征无统计学差异,见图3。
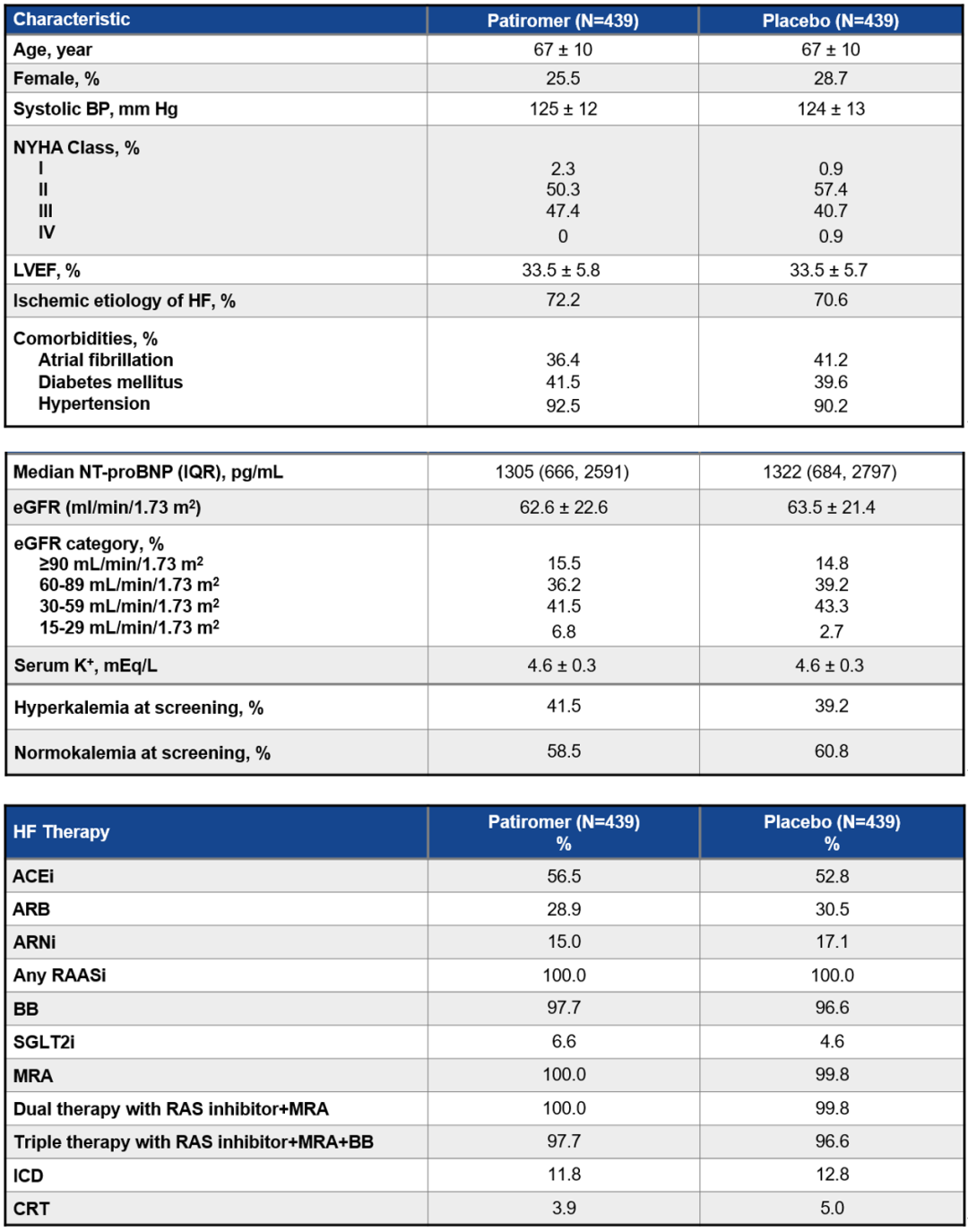
图3 患者的基线特征和心力衰竭药物治疗情况
主要终点事件:
随机化一周后,两组之间的血清K+的平均变化就呈现出统计学差异。研究结束时(54周),Patiromer组的血清K+平均升高了0.03 mEq/L,而安慰剂组平均升高了0.13 mEq/L,两组差异具有统计学意义(P<0.001),见图4。在整个试验期间,与安慰剂相比,Patiromer显示出更佳的治疗效果。
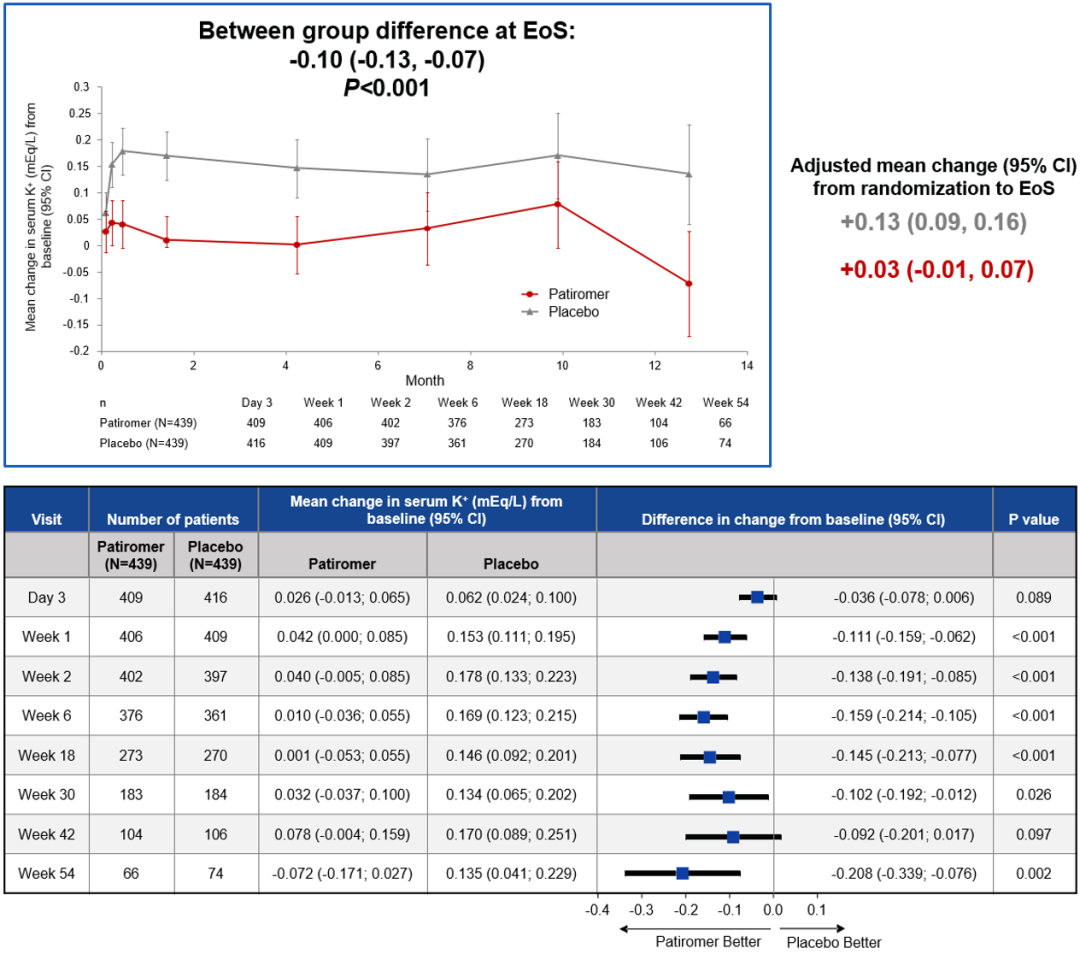
图4 试验期间两组血清K+水平的变化情况
次要终点事件:
Patiromer组和安慰剂组高钾血症(>5.5 mEq/L)首次发生的比例分别为13.9% vs 19.4% (HR 0.63, 95%CI 0.45-0.97, P=0.006),见图5。与安慰剂相比,Patiromer组使用靶剂量MRA的时间显著长于安慰剂组(HR 0.62;95%CI 0.45-0.87,P=0.006),见图6。两组高钾血症事件发生总数分别为225(77.7/100患者年)vs 316(118.2/100患者年)[HR 0.66, 95%CI 0.53-0.81, P<0.001],见图7;Patiromer组高钾血症相关临床结局的胜率为1.53(95%CI 1.23-1.91,P<0.001),RAASi使用得分的胜率为1.25(95%CI 1.003-1.564,P=0.048),见图8。上述数据均说明Patiromer的治疗效果优于安慰剂。
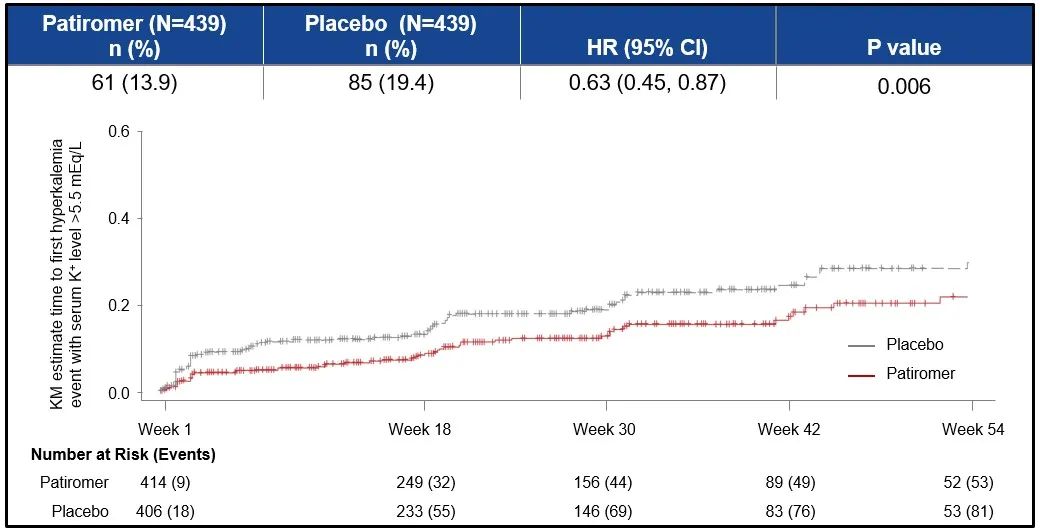
图5 两组首次发生高钾血症(>5.5 mEq/L)的K-M曲线
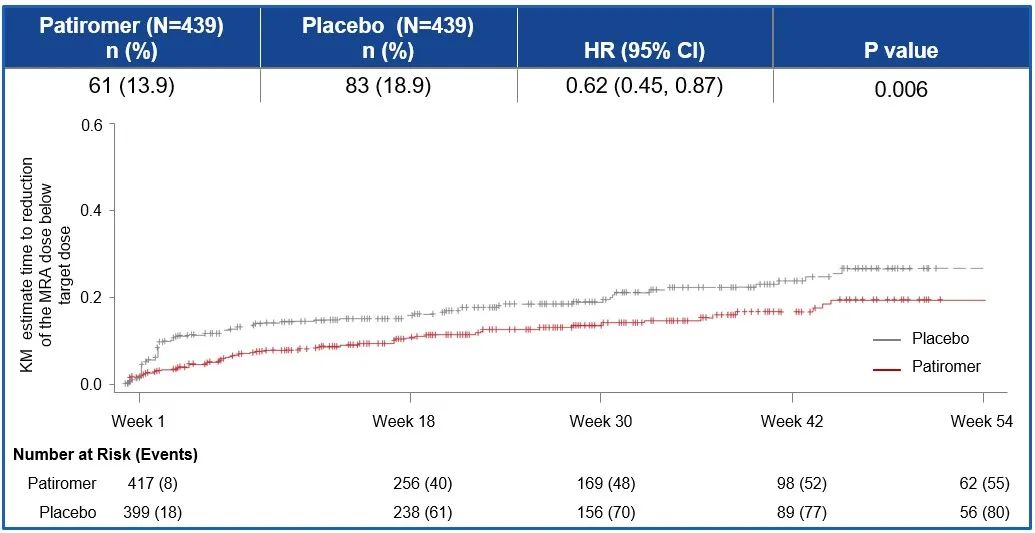
图6 两组MRA减量至靶剂量之下的K-M曲线
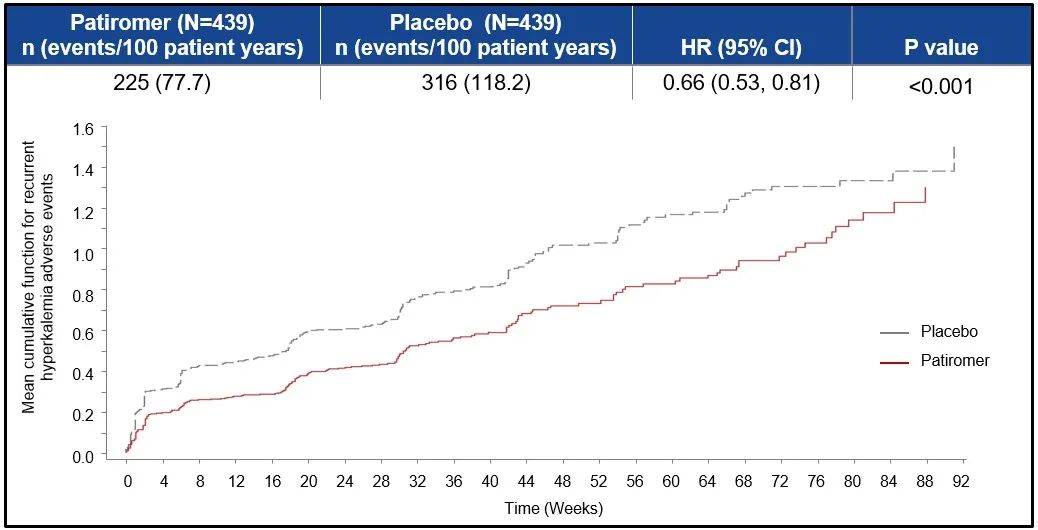
图7 高钾血症事件发生总数(首次和复发)
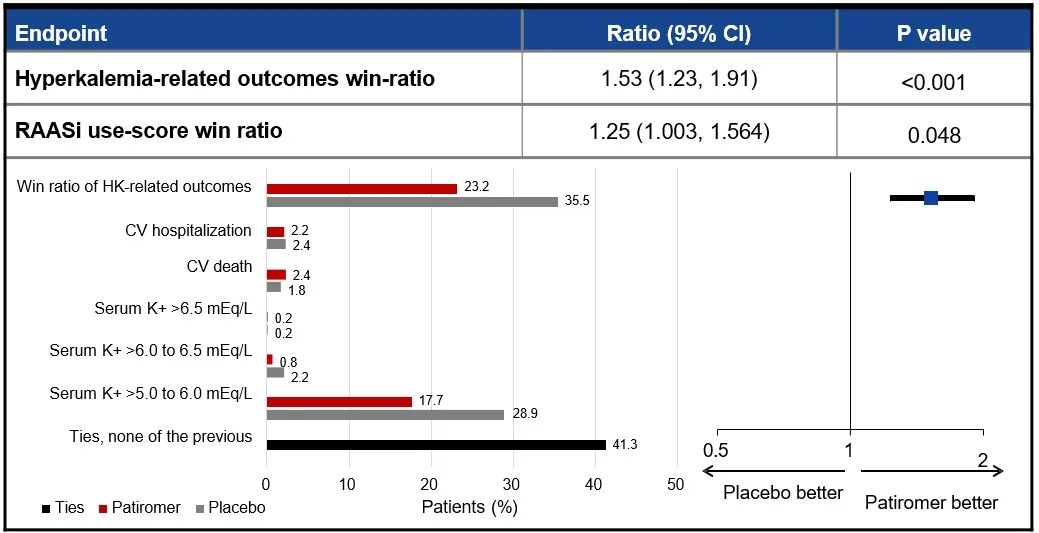
图8 高钾血症相关临床结局和RAASi使用得分的win-ratio
其他终点事件:
Patiromer组和安慰剂组相比,MRA剂量减少或停药或血清K+>5.5 mEq/L的发生比例分别为21.6%比26.7%,P=0.030,差异具有统计学意义;RASSi剂量达到靶剂量50%及以上的比例分别为92%比 87%,P=0.015,差异具有统计学意义。但两组在CV死亡、全因死亡、总CV住院、首次心衰住院时间、总心衰住院等事件发生方面没有明显差异,见图9。
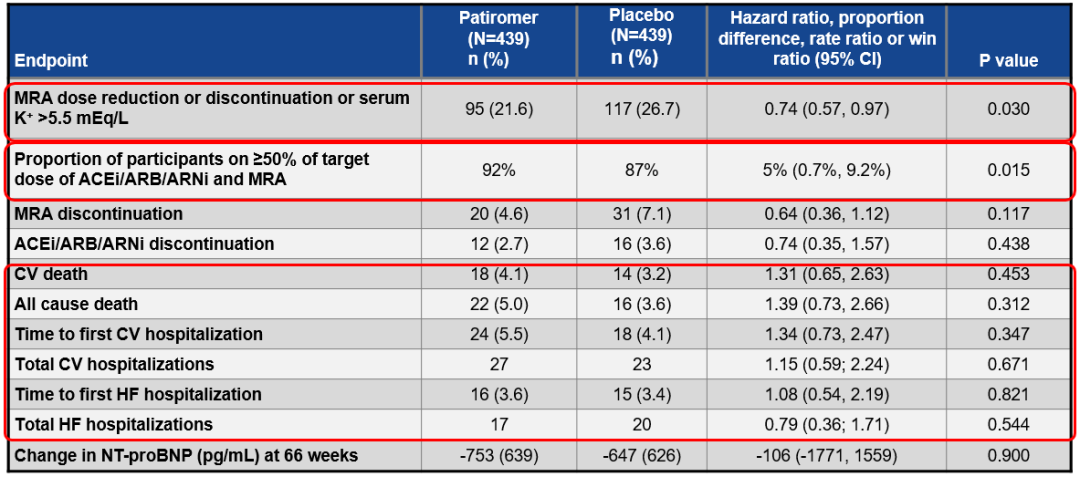
图9 其他终点事件的发生情况
不良反应事件:
Patiromer的安全性良好,两个研究组的不良事件发生率相当,见图10。
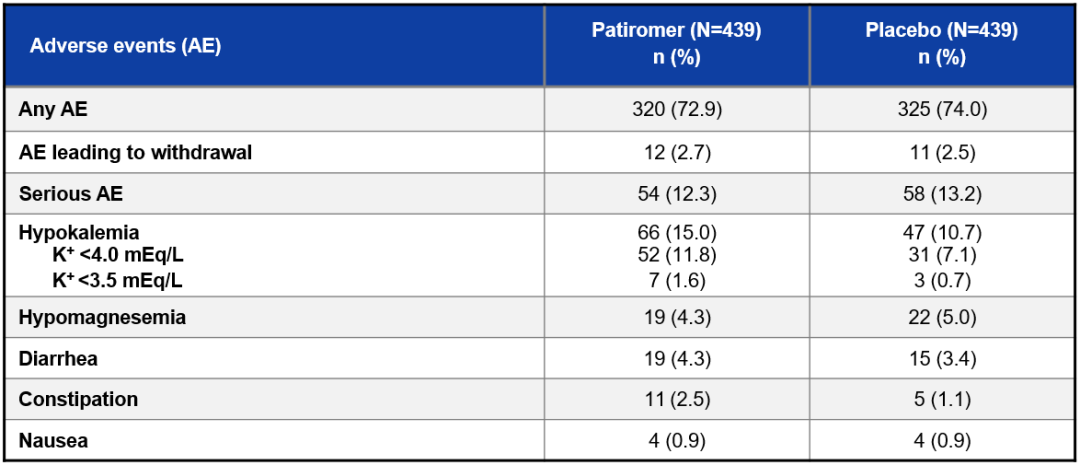
图10 两组不良反应事件
总结与展望
Patiromer能够维持较低的血清K+水平,并且降低严重高钾血症(>5.5 mEq/L)事件的发生率。有利于HFrEF患者在指南指导下接受最佳剂量RAASi(包括MRA)的治疗。Patiromer的试验结果为HFrEF患者提供了一种既能够获得适当的RAASi治疗同时又降低高钾血症风险的有利策略。由于COVID-19大流行,试验短暂暂停以重新设计目标,以后仍需要更多试验来评估使用Patiromer对患者预后的影响。
参考文献
[1]. Presented by Dr. Javed Butler at the American College of Cardiology Annual Scientific Session (ACC 2022), Washington, DC, April 3, 2022.
[2]. Butler J, Anker SD, Siddiqi TJ, Coats AJS, Dorigotti F, Filippatos G, Friede T, Göhring UM, Kosiborod MN, Lund LH, Metra M, Moreno Quinn C, Piña IL, Pinto FJ, Rossignol P, Szecsödy P, Van Der Meer P, Weir M, Pitt B. Patiromer for the management of hyperkalaemia in patients receiving renin-angiotensin-aldosterone system inhibitors for heart failure: design and rationale of the DIAMOND trial. Eur J Heart Fail. 2022 Jan;24(1):230-238. doi: 10.1002/ejhf.2386. Epub 2021 Dec 9. PMID: 34800079.
责编:黄博平 邹长虹
审稿:张宇辉