右心衰竭的定义
右心衰竭是指任何原因引起的右心室收缩和(或)舒张功能障碍,不足以提供机体所需要的心输出量时所出现的临床综合征。
右心衰竭的诊断至少具备两个特征:
与右心衰竭一致的症状和体征;
右侧心脏结构和(或)功能异常,或有右侧心内压增加的客观依据。
围手术期右心衰竭
围手术期右心衰竭的常见原因主要包括:
体外循环心脏手术后心肌水肿、术中心肌保护不理想等因素导致的心肌收缩功能下降。
低氧血症、高碳酸血症、酸中毒、交感兴奋、机械通气和体外循环等造成的右心室压力负荷过重。因二尖瓣/主动脉瓣病变或严重左心室功能障碍行心脏移植的肺动脉高压患者,供体的心脏不能很快适应肺动脉高压,易造成右心室衰竭。
因三尖瓣、肺动脉瓣反流或心内分流导致的右心室容量负荷过重。
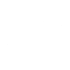
心脏术后右心功能不全的原因分析

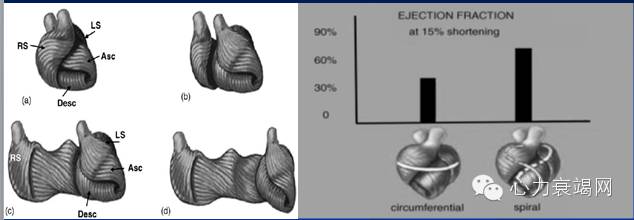
室间隔主要运动是扭转射血和交替扭转快速充盈。
右心室的发动机是室间隔,而不是游离壁。
高达1/3的右室搏出功由室间隔扭转收缩完成。
室间隔收缩功能丧失约降低50%的右室峰值压。
一个心室的大小、形状及顺应性,通过直接的机械相互作用影响另一个心室的大小、形状及压力-容量关系
左心衰竭是右心衰竭之父
约20%~40%的右室收缩压和排出量由左心室收缩完成
室间隔正常凸向右心室
室间隔左侧面的增厚幅度大于右侧,右侧面正常化延迟长于左侧
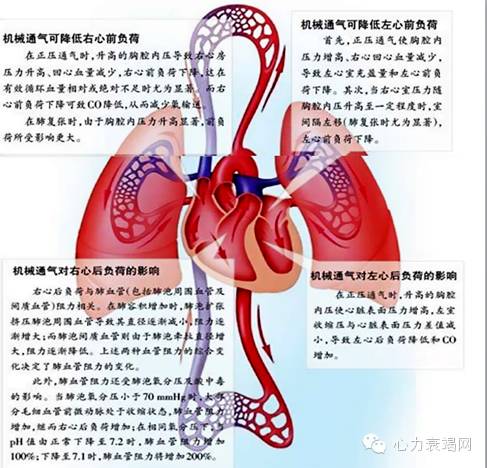
1.胸内压改变对静脉回流和右心功能的影响
在正常情况下,肺部的血容量约为450ml。平静呼吸时,肺部的血容量在430ml ~ 480ml范围内变化。平静呼气末胸内压约为-3mmHg ~ -5 mmHg,吸气末为-5mmHg~ -10 mmHg。用力呼气时,肺部总血容量可减少至200ml左右,胸内压可升高到100 mmHg。而在用力吸气时,肺部总血容量可增大到1000ml,胸内压可降至-90 mmHg。
2.肺容积改变对右室后负荷和右心功能的影响
肺血管阻力(PVR) 取决于肺泡血管和肺泡外血管(肺间质血管) 的平衡。肺充盈超过功能残气量(FRC) 时,由于肺泡的扩张使肺血管受到挤压,使PVR 升高。肺容积下降时,一方面,由于肺泡外血管急剧扭曲而倾向于塌陷;同时,由于周边气道塌陷引起肺泡缺氧,当氧张力低于60 mm Hg 时可导致缺氧性肺血管收缩。这两方面因素导致PVR 升高,肺动脉压升高,妨碍右室射血。
3.机械通气对心脏的影响
4.ALI/ARDS增加右室后负荷
反射系数( δ ): 防止胶体渗透过半透膜的能力,δ接近1.0时,胶体不能透过毛细血管膜而进入血管外间隙
不同组织的δ变化很大 肺 0.6 肌肉 0.9 脑0.99 肾小球 1.0 肝脏≈0
创伤、脓毒血症 , δ值明显变化
手术创伤区域组织的δ↓形成“ Capillary Leak”
5.其它肺部原因
COPD存在内源性PEEP,增高胸内压及肺血管阻力
哮喘、拔管后喉痉挛使胸内压急剧下降,导致负压性肺水肿;
缺氧及高碳酸血症导致肺血管收缩、肺毛细血管压升高
肺动脉高压术后因缺氧、酸中毒、高碳酸血症、肺不张、过度膨肺等原因升高
急性肺血栓栓塞
心搏出量不足(肾血管收缩)
心源性休克(肾灌注减少)
中心静脉增加,引起肾脏低灌注
腹内压增高
围术期冠脉缺血:右室心梗、左室心梗累及室间隔
体外循环心脏手术后心肌水肿、术中心肌保护不理想
脓毒血症、心脏移植供体的心肌损伤
慢性血栓栓塞性肺动脉高压
重症瓣膜病(如:重度二尖瓣狭窄、肺高压、三尖瓣大量反流)
严重先心病(如:严重三尖瓣下移畸形导致的右室发育差,收缩功能低下)
围手术期右心衰竭是影响心脏移植手术成功的一个重要因素
如果肺动脉收缩压>60mmHg合并以下任何一项:肺血管阻力(PVR)>5 Wood单位、PVR指数(PVRI=PVR/CI)>6 Wood.m2、跨肺动脉压力梯度(TPG=肺动脉平均压—肺毛细血管楔压)超过16~20mmHg,术后发生右心衰竭和早期死亡的风险增加
如果PVR能降至2.5 Wood单位,但是同时出现体循环收缩压低于85mmHg,仍然存在术后右心衰竭和死亡的高风险
肥厚梗阻心肌病:起病年纪轻,全心肥厚程度重,合并冠脉肌桥的患者术后可能发生右心功能不全
右心室舒张功能不全:心脏水肿严重,心室顺应性下降;心包缝合、肥胖女性胸廓内容积小、纵膈气肿等原因造成心室舒张受限
右心室起搏、术后完全性束支传导阻滞导致异常激动顺序、心脏运动不同步
心脏术后右心功能不全的临床表现
中心静脉压升高
血压可维持在正常水平,右心严重超负荷时血压处于低水平,甚至出现一过性血压显著下降
各种类型心律失常,轻度右心衰竭时以心房颤动、心房扑动、室上性心动过速为主;严重右心衰竭时可处现恶性室性心律失常
尿量减少或无尿
较少出现严重组织灌注不良的表现
可伴有低氧血症、胸腔积液
拔管后患者出现呼吸困难;烦躁、坐卧不安、激越等精神症状
术后顽固性腹胀、甚至麻痹性肠梗阻
心脏术后右心功能不全的治疗
治疗原则:
首先针对导致右心功能不全的原发病进行治疗
减轻右室前、后负荷
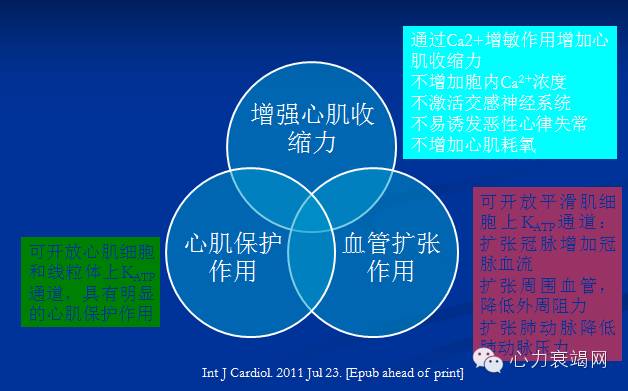
增强心肌收缩力
维持窦性节律、房室正常顺序和间期以及左右心室收缩同步
减轻前负荷同时关注心肾综合治疗
容量状态、血压、心输出量、贫血和基础肾病的评估至关重要,需要深入了解患者的临床因素,寻找平衡点,兼顾心脏及肾脏,制定个体化的治疗措施
心脏: 正性肌力药、血管扩张药,机械辅助治疗(IABP、ECMO)
肾脏:利尿剂,机械辅助治疗(CRRT)
利尿是治疗ADHF的基石!
能减轻高容量负荷,改善心力衰竭,防止AKI发生
利尿治疗是一把双刃剑!
利尿不当,激活神经体液介质,减少肾血流量,诱发AKI
口服利尿效果差:速尿仅50%,布美他尼及托拉塞米的80%,经消化道吸收,心衰时消化道粘膜水肿吸收更差
静脉给药宜持续点滴:避免弹丸式给药,给药间歇期髓袢重吸收“Na”反跳,利尿效果减弱;收缩肾髓质血管加重肾损伤,应逐渐加大剂量。
腺苷调节入球小动脉收缩,增加近端肾小管重吸收钠。腺苷受体亚型1(A1)拮抗剂阻止肾小球滤过率下降、促进排尿
Givertz等报道了选择性腺苷A1拮抗剂Rolofylline(KW-3902)两个Ⅱ期临床研究的结果,分别观察了ADHF伴肾功能不全的患者以及心功能Ⅲ或Ⅳ级伴利尿药抵抗的患者,证实了腺苷受体拮抗剂在加强利尿和保存肾功能方面的潜在作用
PROTECT 和REACH UP试验(安慰剂对照随机研究),均未证实Rolofylline对有近期急性肾功能恶化的ADHF患者临床状态或肾功能的益处

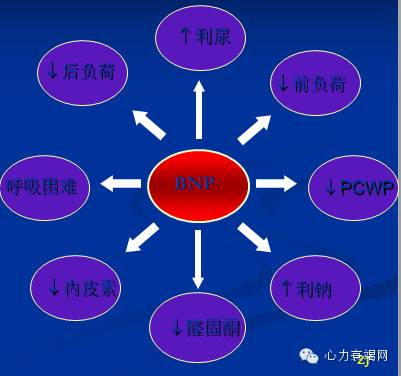
抑制集合管对NaCL的重吸收
增加肾血流和GFR
抑制肾素分泌
抑制醛固酮分泌
抑制ADH分泌
肾脏替代治疗

临床符合其中一项,应开始CRRT 治疗;符合两项应立即开始治疗。
尿素(肌酐)改变的速度较其绝对值更为重要
较早开始肾脏支持,尽管多数病例应当在尿素 20 - 30 mmol/L之间开始RRT,但多数情况下,在尿素升至上述水平前开始RRT是合理的
应当在出现并发症之前开始治疗
出现危及生命的情况应立即开始:严重高钾(大于6.5 mmol/L) 、严重酸中毒(PH 小于7.0 )、肺水肿、脑水肿、尿毒症并发症
根据液体平衡、尿量、血钾水平或酸中毒程度,结合患者临床情况而定
CRRT和IRRT均可作为AKI患者的补充治疗(澳大利亚、新西兰起始治疗几乎全部选择CRRT)
目前尚无证据支持CRRT能够较IHD降低病死率,但有证据支持CRRT时肾脏预后更佳
对血流动力学不稳定,或依赖血管活性药的患者推荐CRRT
对急性脑损伤,或任何原因导致的颅内压升高、脑水肿患者,推荐CRRT
目前证据不支持CRRT的各种治疗模式之间存在差别,但CVVH、CVVHDF为常用的治疗模式
IHD可用于血流动力学稳定患者的疾病恢复期
腹透不应常规用于合并AKI的ICU危重患者n
肺动脉高压的特异性治疗