

重要亮点
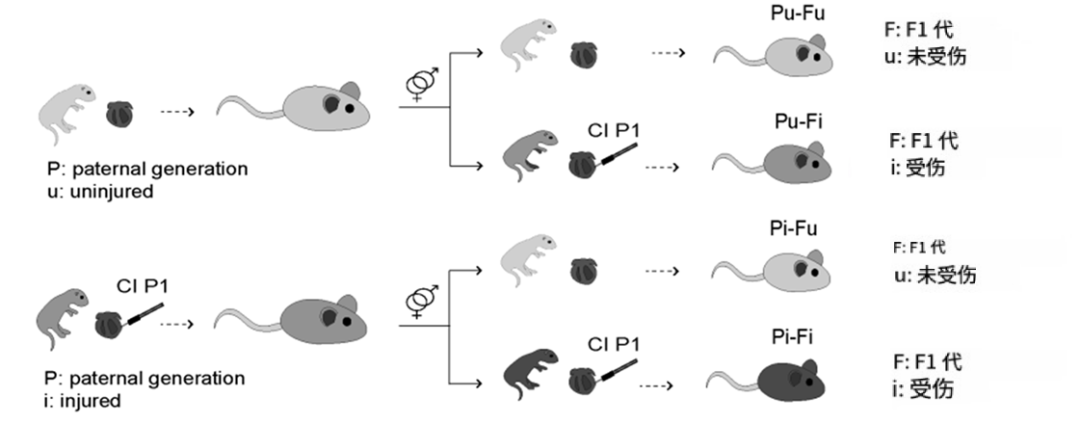
● 研究设计:新生期雄性小鼠接受左心室冷冻损伤,成年后与未受伤雌鼠交配,子代被用于研究父源性心脏损伤对其心脏适应性的影响。
● 心脏结构变化:子代即使在无损伤情况下,其左心室质量和体积显著高于对照组,提示存在先天性心脏结构适应。
● 功能性增强:在相同心脏损伤条件下,来自受损父鼠的子代具有更高的心输出量与每搏输出量,显示出更好的心脏功能和恢复能力。
● 分子机制:子代心脏组织中钙信号通路(包括Camk1d)和心肌肥大相关基因表达上调,同时免疫修复细胞比例增加。
● 系统性保护:子代在断奶期体重、肝重更大,外周器官表现出肝脏骨髓外造血减少与修复更快的迹象。
● 潜在意义:父源性新生期心脏损伤可诱导子代出现保护性心脏适应,为心血管疾病的遗传影响提供新视角。
研究背景
尽管已有大量证据表明,母体在产前的暴露情况和产后早期的环境因素都会对后代心血管系统产生深远影响,但关于父母早期应激经历是否也具有类似影响仍缺乏系统研究。与母系遗传不同,父系遗传的影响主要通过精子中携带的遗传与表观遗传信息实现,避免了宫内环境的混杂干扰,因此是研究亲代经历对后代表型影响的理想模型。
近年来,越来越多的研究揭示,父亲的饮食结构、有毒物质暴露、心理创伤等生活经历会影响子代的表型特征,这一现象被称为“父源性跨代遗传”。此外,父亲的年龄、吸烟与饮酒行为等也被发现与后代表现出更高的先天性心脏畸形风险相关。
值得注意的是,临床观察表明,父母发生心肌梗死的年龄越早,其子代患心血管疾病的风险也越高。然而,父母自身的心脏损伤是否会直接作用于后代的心脏功能,目前仍缺乏明确证据。动物实验研究发现,慢性肝损伤可诱导大鼠后代在再次遭遇肝损伤时表现出适应性增强,这提示器官损伤具有可能跨代传递的适应信号。
为此,本研究通过对新生小鼠实施左心室冷冻损伤(Cryoinjury, CI)模拟急性心脏损伤,系统评估其成年后所生子代在分子、生理及结构层面所表现出的心脏变化,从而验证父源性心脏损伤是否具有跨代影响。
研究方法
在本研究中,研究者探讨了父代早期心脏损伤对C57BL/6J小鼠第一代子代的影响。动物实验相关数据已公开发布。
为了研究父代心脏损伤对下一代可能产生的影响,研究人员在雄性小鼠出生后第1天实施了心脏冷冻损伤处理。这种损伤模型已知诱导急性损伤并进行再生或形成瘢痕。之后,受伤雄鼠被饲养至成年,与未受伤雌鼠交配。作为对照组,选取来自相同遗传背景的同龄未受伤雄鼠,同样与未受伤雌鼠交配,获得第一代子代。
研究结果
在生理条件下,受伤父亲所生子代在出生后3周时的心脏形态已与未受伤父亲的子代有所不同。超声心动图分析显示,与未受伤父亲的未受伤子代相比,来自受伤父亲的未受伤子代在收缩期和舒张期的左心室(LV)内径和体积均较大,二尖瓣E波速度也更高,提示其左心室扩张程度更强。
接下来,研究者进一步评估了这些改变是否会影响心脏对新生期冷冻损伤(出生第1天实施)后的反应。在损伤后第3周,来自未受伤父亲(Pu-Fi)与受伤父亲(Pi-Fi)的小鼠后代在左心室扩张程度上的差异并不明显。然而,与Pu-Fi相比,Pi-Fi表现出显著增加的左心室质量,同时心输出量和每搏量也更高。
在心肌部分收缩功能丧失的情况下,心脏通常会通过肥大性重塑来维持搏出量,确保其他器官获得充足灌注。本研究的数据显示,具有心脏损伤父系背景的小鼠具备更强的心脏重塑能力,能在压力条件下更好地维持心脏功能。
分子层面的数据进一步支持了上述观察。与Pu-Fi相比,Pi-Fi心肌细胞中与心肌肥大相关的基因(如Camk1d、Prkar2b和Car3)表达水平更高。此外,Pi-Fi 小鼠体内参与 Pi3-Ca2+ 通路的基因水平较高,这支持了其心脏对损伤产生肥厚反应的表型观察结果。
正常情况下,心脏主要依赖脂肪酸氧化维持其持续收缩。然而,在遭受心脏损伤时,由于氧供应减少,代谢模式会从脂肪酸氧化转为糖酵解,进而导致心肌细胞内脂滴的堆积。研究结果显示,Pu-Fi心肌细胞中脂滴明显增多,而Pi-Fi则较为稀少;同时,Pi-Fi心脏外膜脂肪组织也少于Pu-Fi。这些结果提示,Pi-Fi中脂肪酸氧化部分恢复,代谢趋于稳态,呈现更有效的代谢调节能力。
研究者还观察到Pi-Fi与Pu-Fi之间存在系统性差异。在肝脏中,Pi-Fi在损伤后第3周的骨髓外造血位点数量减少,这是炎症减轻的表现。同时,Pi-Fi的肝糖原沉积减少,循环中的游离脂肪酸、游离胆固醇和高密度脂蛋白水平上升,表明其具备更强的新陈代谢能力和脂质动员能力,用以应对损伤带来的应激反应。
进入成年阶段后,受伤父亲的未受伤子代已不再表现出左心室扩张现象,提示出生后心脏发育过程中增强的可塑性为一过性变化。然而,与未受伤父亲相比,受伤父亲的受伤子代其左心室质量(P=0.0905)和每搏量(P=0.0632)仍部分维持较高水平,说明损伤对下一代的影响在一定程度上具有持久性。
研究结论
研究结果表明,具有新生期心脏损伤史的父代,其第一代子代整体表现出更高的心脏修复能力。在生理状态下,这些子代在出生后的心脏发育过程中会出现一过性的左心室扩张;而在遭遇心脏损伤时,他们表现出更显著的心脏结构重塑和更强的新陈代谢能力,有助于维持心脏功能并促进全身系统的恢复。未来的研究可以进一步探讨,在个体生命过程中,其他压力因素是否会加剧或改变这些由父代心脏损伤引发的跨代效应。祖代在生命早期阶段所受到的各种刺激,可以通过多种机制传递至后代,并影响其健康状况。基于父代新生期胸廓切开术的研究结果表明,无菌性炎症可能是新生期心脏损伤时引发系统性改变,进而影响配子信息的重要机制。未来仍需进一步研究,以揭示新生儿心脏损伤如何实现跨代传递的分子机制。
参考文献
Coppe B, Galardi-Castilla M, Sanz-Morejón A, Arora P, Lucas J, Iciek C, Lalaguna L, Lara-Pezzi E, Flores I, Mercader N. Paternal Cardiac Lesion Induces Cardiac Adaptation in Offspring. Circulation. 2025 Apr;151(13):968-971. doi: 10.1161/CIRCULATIONAHA.124.070323. Epub 2025 Mar 31. PMID: 40163557.