

2022年8月26日,《2022 ESC肿瘤心脏病指南》于欧洲心脏病学会(ESC 2022)年会上重磅发布。本指南是继《2016 ESC肿瘤治疗与心血管毒性立场性文件》后,又一里程碑式文件。本指南旨在帮助指导医务人员全程管理肿瘤患者,对抗肿瘤治疗相关的心血管毒性(Cancer therapy-related cardiovascular toxicity,CTR-CVT)的定义、诊断、治疗和预防以及由肿瘤直接或间接引起的心血管疾病的管理提供指导。
肿瘤心脏病学科的目的是为肿瘤患者安全使用抗肿瘤治疗方法保驾护航,以尽可能减少肿瘤治疗相关心血管不良反应的发生。具体流程应为:在开始抗肿瘤治疗之前,肿瘤心脏病团队首先应识别和管理心血管相关危险因素,治疗已知心血管疾病,并为肿瘤患者提供完善的肿瘤心脏病监测方案;在抗肿瘤治疗过程中,如发现新发的心血管问题,应该进行跨学科交流,讨论肿瘤患者抗肿瘤治疗的存续问题;抗肿瘤治疗结束之后,应该与肿瘤治疗团队进行长期的合作,随访监测患者的心血管健康情况(图1)。
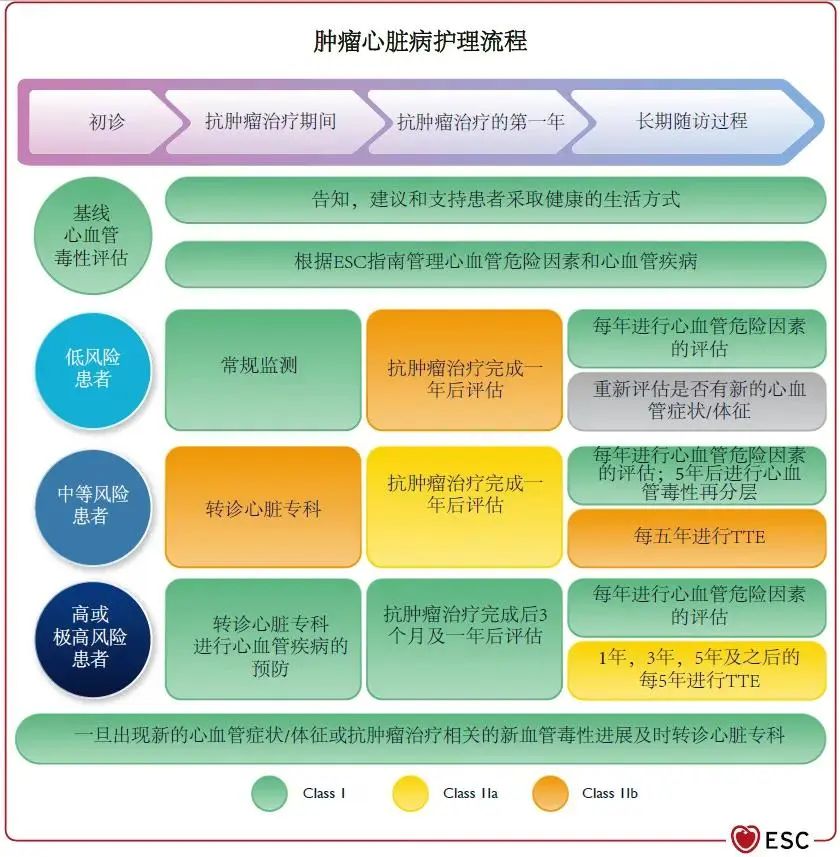
图1 肿瘤心脏病管理路径
肿瘤心脏病学科的总体原则是多学科协作。肿瘤心脏病团队应该有广博的知识面,涵盖肿瘤、心血管和血液病等学科,多角度、多方面提出管理建议。CTR-CVT的动态演变取决于患者的基线心血管风险和随暴露动态变化的心血管毒性。在开始抗肿瘤治疗前,通过风险分层工具将肿瘤患者分为低、中、高和极高危的心血管并发症风险(推荐通过由ESC心力衰竭协会与国际肿瘤心脏病学会[ICOS]联合发布的评分进行危险分层)。CTR-CVT的严重程度、持续时间和表现类型因恶性肿瘤类型和抗肿瘤治疗的类型而异。风险本身可以从两方面来理解:(1)发生的可能性;(2)并发症的严重程度。风险分层可以帮助决定后续肿瘤治疗的存续(图2)。

图2 癌症治疗相关心血管毒性风险和疾病严重程度的维度
在肿瘤心脏病学科探索过程中,对CTR-CVT的定义未形成规范,导致诊断和管理的混乱。本指南对CTR-CVT进行了明确的定义(表1),包括肿瘤治疗相关的心功能不全/心力衰竭/心肌病、心肌炎、血管毒性、高血压、心律失常、QT间期延长。对于心脏损伤、心肌病和心力衰竭,推荐使用专用术语—抗肿瘤治疗相关心功能不全(Cancer therapy-related cardiac dysfunction,CTRCD)。
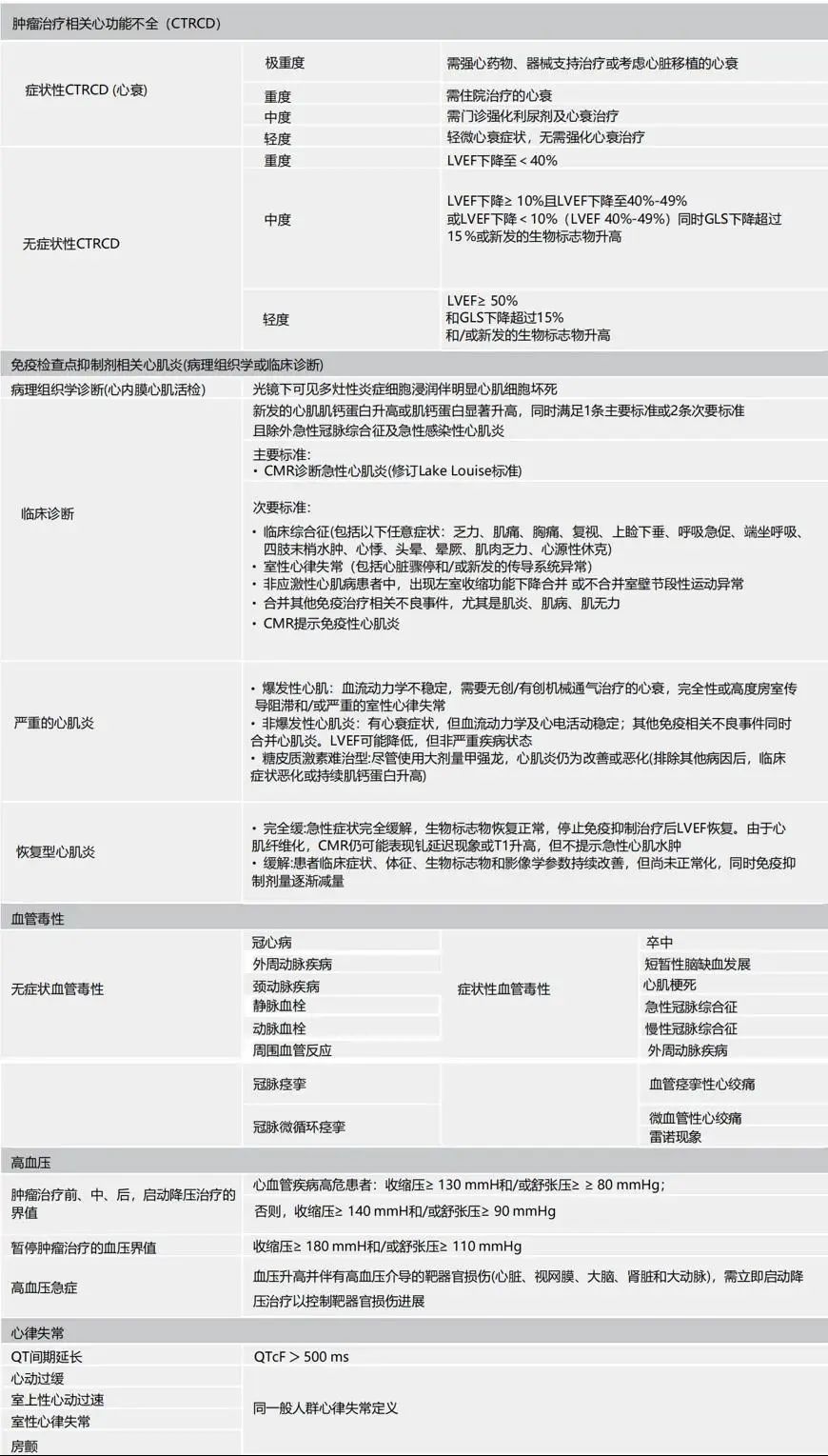
表1抗肿瘤治疗相关的心血管毒性定义
在肿瘤患者中进行心血管疾病预防的最佳时间是抗肿瘤治疗前。在这个时间点,肿瘤治疗团队可以评估患者心血管风险,个体化制定心血管随访监测策略,并让高危患者转诊肿瘤心脏病专科门诊,可以有效降低未来心血管疾病的风险,并增加患者后续抗肿瘤治疗的依从性。因此,基线心血管风险评估的重要性尤为突出,图3提供了基线心血管风险评估的流程。
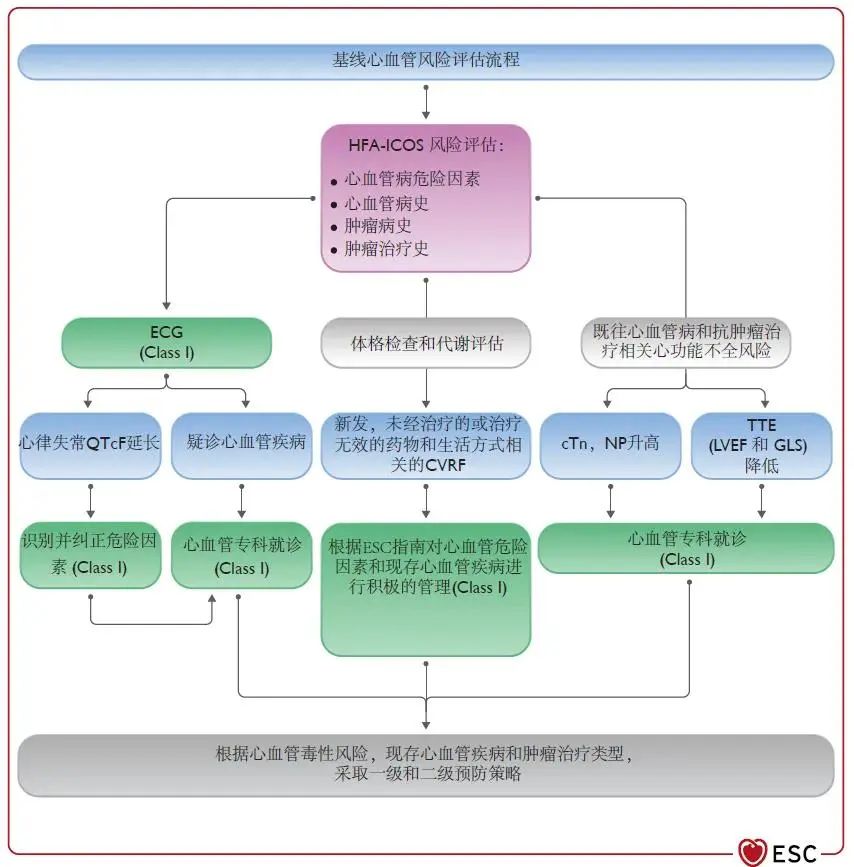
图3 基线心血管风险评估
中风险患者可获益于密切的心脏监测和严格的心血管风险因素(CV risk factors,CVRF)管理,某些中风险患者也可获益于肿瘤心脏病学专科转诊(图4)。对于低风险患者,应当进行跟踪随访,以防出现CTR-CVT或出现新发的或不受控制的CVRF,而一旦出现,则应该转诊至肿瘤心脏病学专科就诊(图4)。
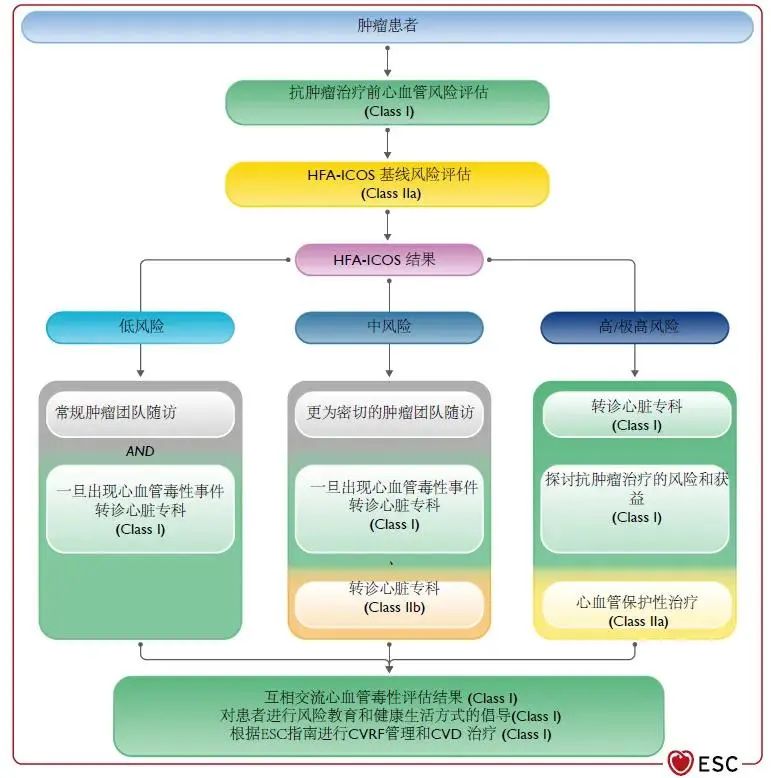
图4 心力衰竭协会-国际心脏肿瘤学会心血管毒性风险评估后肿瘤心脏病学科就诊流程
进行基线风险评估时,应当仔细的询问临床病史并进行体格检查。对于既往无CVD或CTR-CVT的患者,可以考虑一级预防策略,而二级预防则对既往或活动性CVD或既往CTR-CVT患者进行干预。基线12导联ECG简单易行,可以为潜在CVD提供重要线索,应作为基线时的检查。此外,测量心脏血清生物标志物心肌肌钙蛋白(cTn)I或T和利钠肽(NP)(例如:B型利钠肽[BNP]或N-末端BNP前体[NT-proBNP])有助于癌症治疗患者的基线CV风险分层,也应在基线风险评估时进行。经胸超声心动图(TTE)在识别亚临床CVD患者、确定心血管疾病方面具有重要作用,能定量评估左室和右室(RV)功能、心室扩张、左室肥厚、局部室壁运动异常、舒张功能、心脏瓣膜病、肺动脉压(PAP)和心包疾病,应在基线时作为重点检查手段(图5)。

图5 使用潜在心脏毒性药物治疗的癌症患者的基线评估建议
1. 抗肿瘤治疗患者心血管毒性的预防
心血管疾病和肿瘤常有共同的危险因素。危险因素的控制和生活方式的改变对肿瘤治疗患者心血管毒性的预防非常重要。首要的是优化生活方式、戒烟、每周饮酒量限制在100克以内,并保持足够的体力活动;另外,应通过强化治疗高血压、糖尿病和血脂异常来纠正CVRF,根据2021 ESC指南来管理已知CVD;此外,还应特别注意的是,肿瘤患者常合并多种药物联合治疗,应将可能干扰肿瘤治疗的药物的使用降至最低,并积极监测CV副作用和药物间的相互作用;除此之外,也应纠正电解质失衡,如低钾血症和低镁血症;最后,CV风险管理计划应与肿瘤专家团队交流,以协调治疗策略。
2. 抗肿瘤治疗患者心血管毒性反应的监测
建议在基线、肿瘤治疗期间和肿瘤治疗结束后进行详细的临床评估、体格检查、影像学检查和实验室检查等,以监测CTR-CVT的早期体征和症状,并早期识别和管理肿瘤治疗相关心血管毒性反应。根据不同的药物方案,有不同的监测流程(图6-图11):
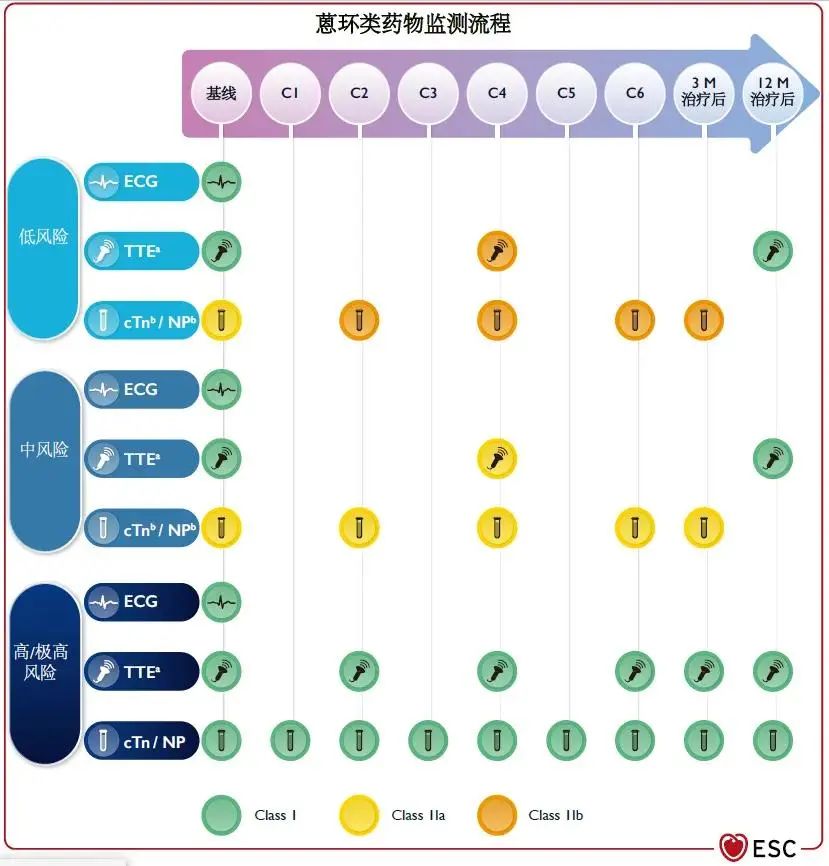
图6 蒽环类药物监测流程
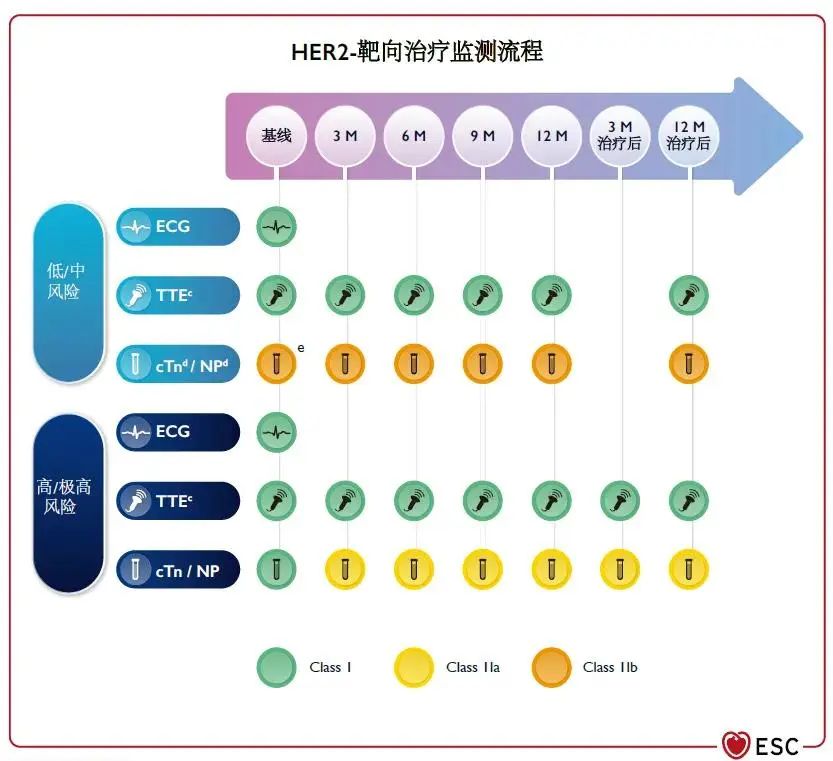
图7 HER-2靶向治疗监测流程
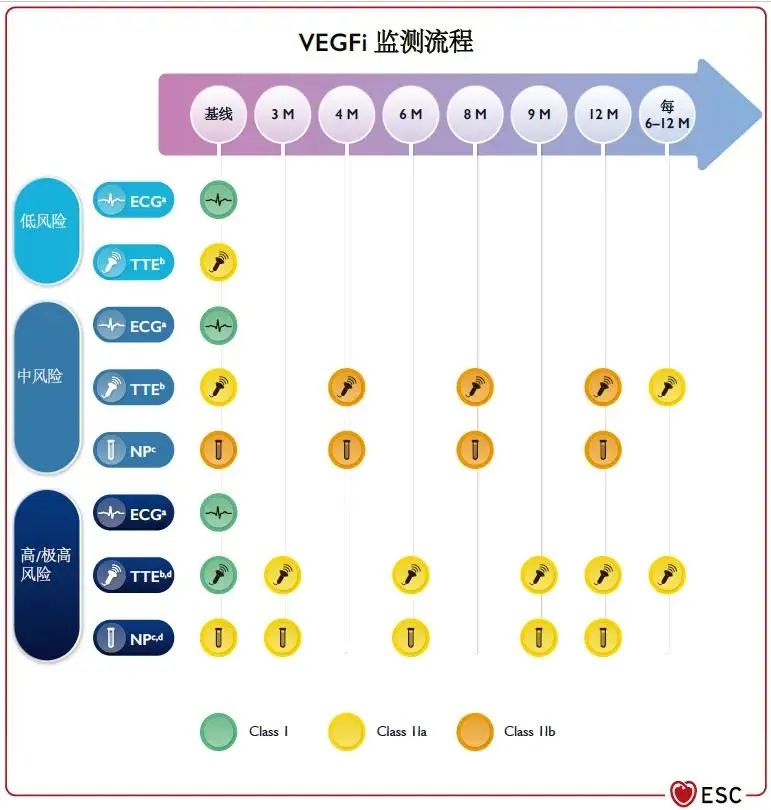
图8 VEGFi监测流程
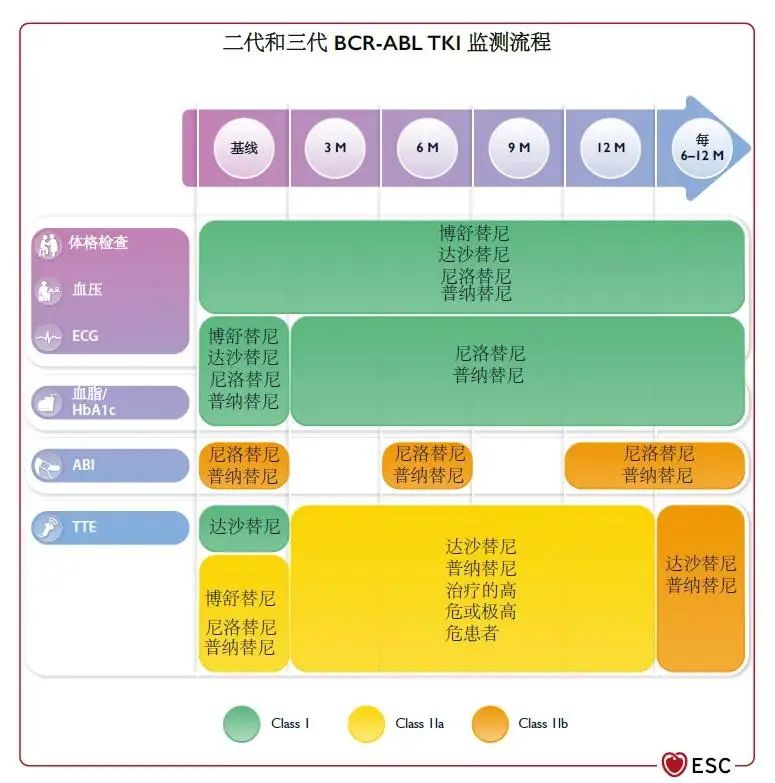
图9 二代和三代BCR-ABL TKI监测流程
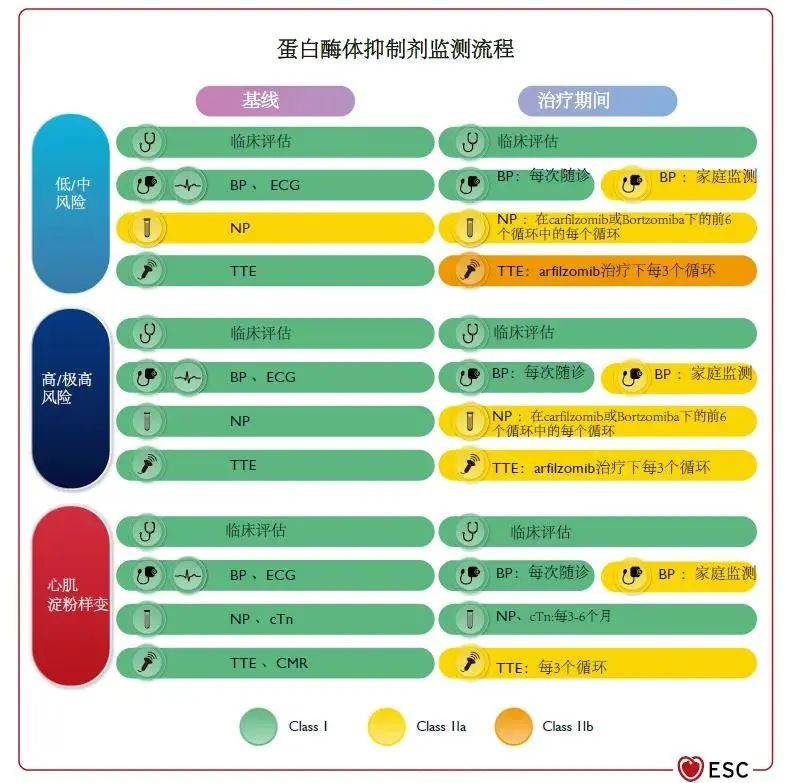
图10 蛋白酶体抑制剂监测流程

图11 免疫检查点抑制剂监测流程
指南推荐多学科团队(Multidisciplinary team,MDT)协同讨论抗肿瘤治疗中出现急性心血管并发症的患者。对于在肿瘤治疗期间和之后出现新的CTR-CVT的肿瘤患者,推荐转诊到专门的肿瘤心脏病服务中心帮助肿瘤患者进行CVD的预防和管理,一般应遵循针对特定CVD的ESC指南。
1. 抗肿瘤治疗相关心功能不全
指南对于不同抗肿瘤治疗引起的心功能不全归纳总结了各自的管理流程,以蒽环类化疗相关的心功能不全为例,蒽环类相关心功能不全患者的管理见图12。指南提出,对于在抗心衰治疗下左室功能恢复后出现轻、中度症状CTRCD,或中度或重度无症状CTRCD的患者,建议进行MDT讨论重新启动蒽环类化疗。如果能够继续蒽环类药物化疗,除了继续以目标剂量使用ACEI/ARB和β-受体阻滞剂外,还提出以下3点建议:首先,尽量减少蒽环类药物化疗的剂量;第二,改用脂质体蒽环制剂;第三,在每个蒽环类化疗周期前用右雷佐生进行预处理。
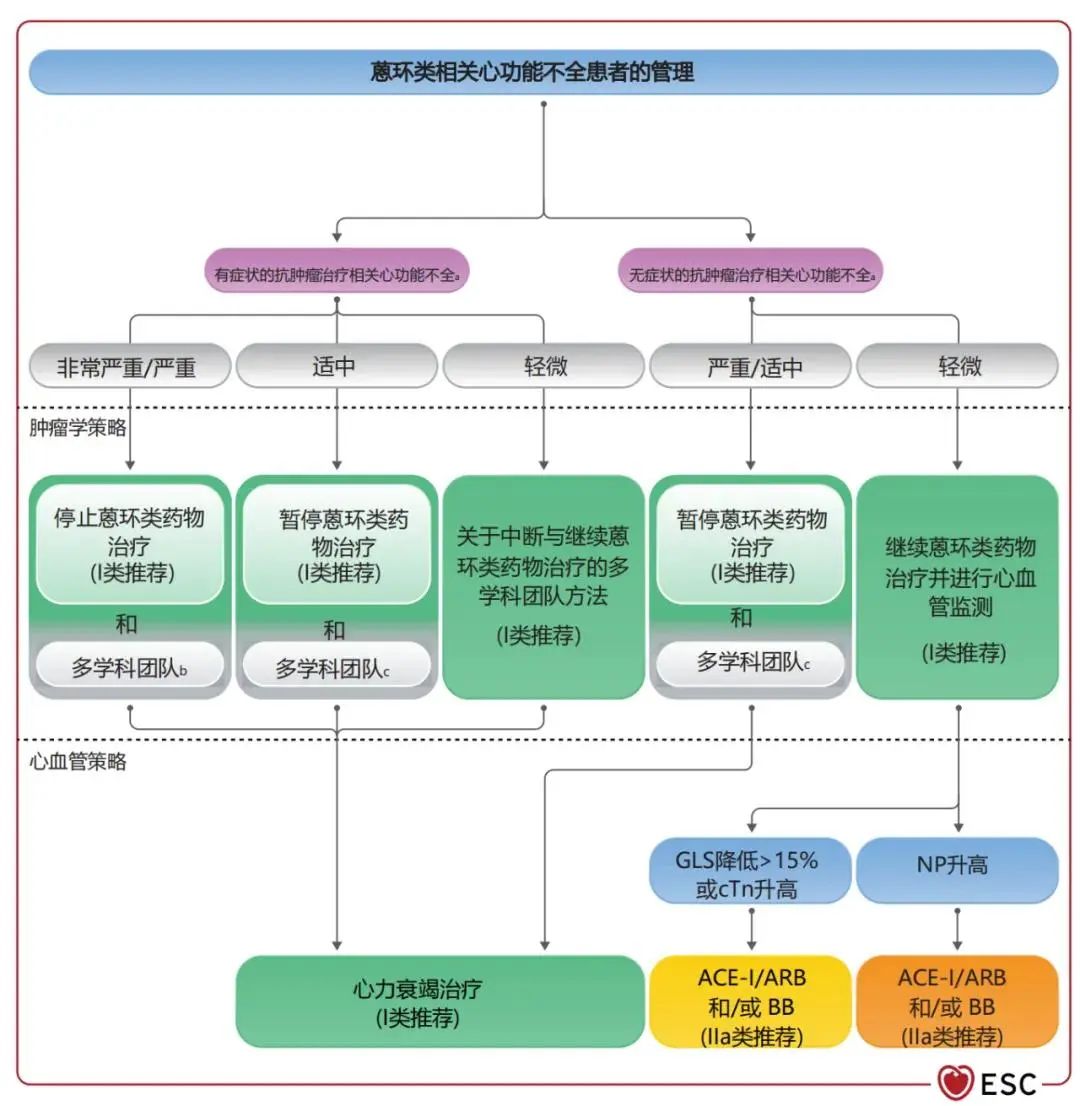
图12 蒽环类相关心功能不全患者的管理
2. 免疫检查点抑制剂相关性心肌炎
心肌炎是免疫检查点抑制剂(Immune checkpoint inhibitors,ICI)治疗的一种严重并发症,病死率高,最常发生在治疗的前12周,但晚期病例(20周后)也可能发生。其他与ICI相关的CV毒性包括血脂异常、急性冠脉综合征、血管炎、房室传导阻滞、室上和室性心律失常、猝死、TTS、非炎症性LVD、心包炎、心包积液和缺血性卒中,其中发生心肌炎(OR值:4.42)和血脂异常(OR值:3.68)的风险更高。图13为ICI相关性心肌炎患者的管理流程。
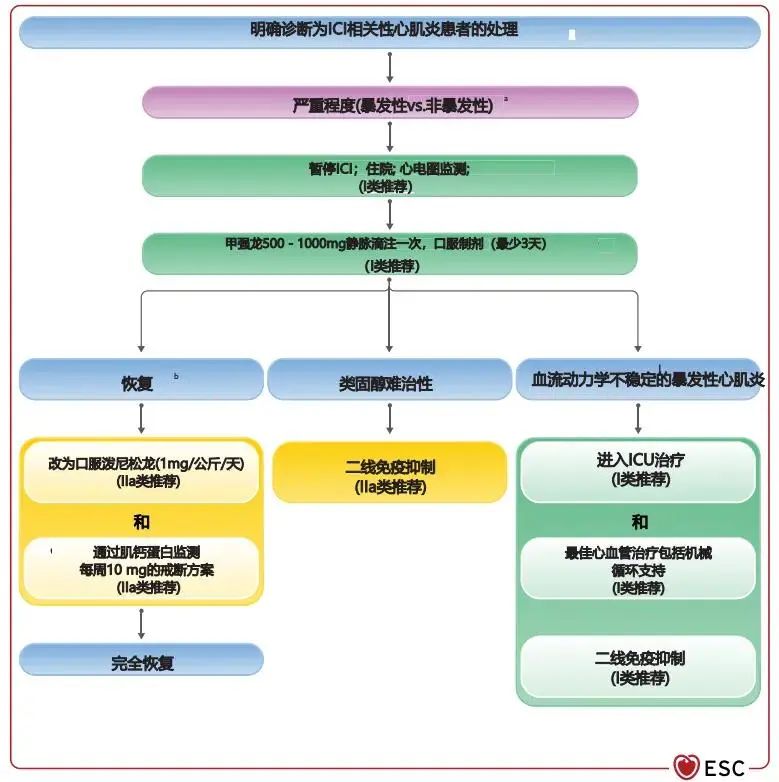
图13 明确为ICI相关心肌炎患者的处理
3. 冠心病
肿瘤治疗相关心血管毒性及肿瘤诱导的促炎和血栓前状态使肿瘤患者患冠心病的风险增加。目前肿瘤患者中患急性冠脉综合征患者的比例正在上升,约占患者的3%。表2为指南中对急性冠脉综合征提出的相应治疗建议。
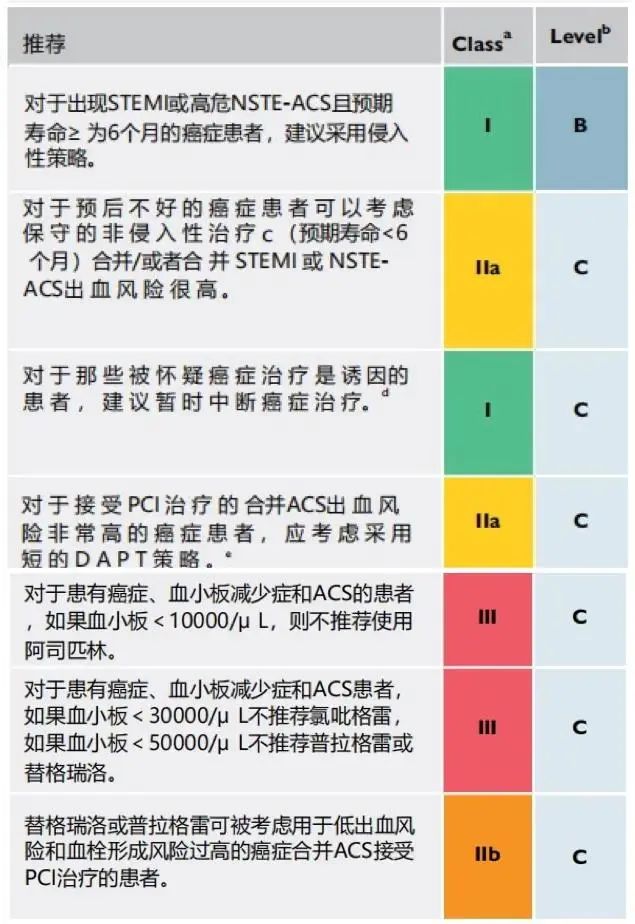
表2 接受抗癌治疗的患者急性冠状动脉综合征的管理建议
4. 瓣膜病
肿瘤患者中新的或恶化的瓣膜性心脏病可能与同时存在的其它并发症相关,包括肿瘤治疗相关心功能不全、急性冠脉综合征、肺动脉高压、心内膜炎、心脏肿瘤和机械性人工瓣膜血栓形成。
5. 心律失常
肿瘤治疗过程中新发房颤的几率约为2%-16%。血栓栓塞/出血风险评估及抗凝策略的选择常是房颤合并肿瘤患者管理的棘手问题。本次指南首次提出了房颤合并肿瘤患者抗凝管理的结构化流程(图14),在CHA2DS2-VASc、HES-BLED评分基础上,开拓性地总结出TBIP血栓/出血评估管理模式(Thromboembolic risk, Bleeding risk, drug–drug Interactions, Patient preferences)。
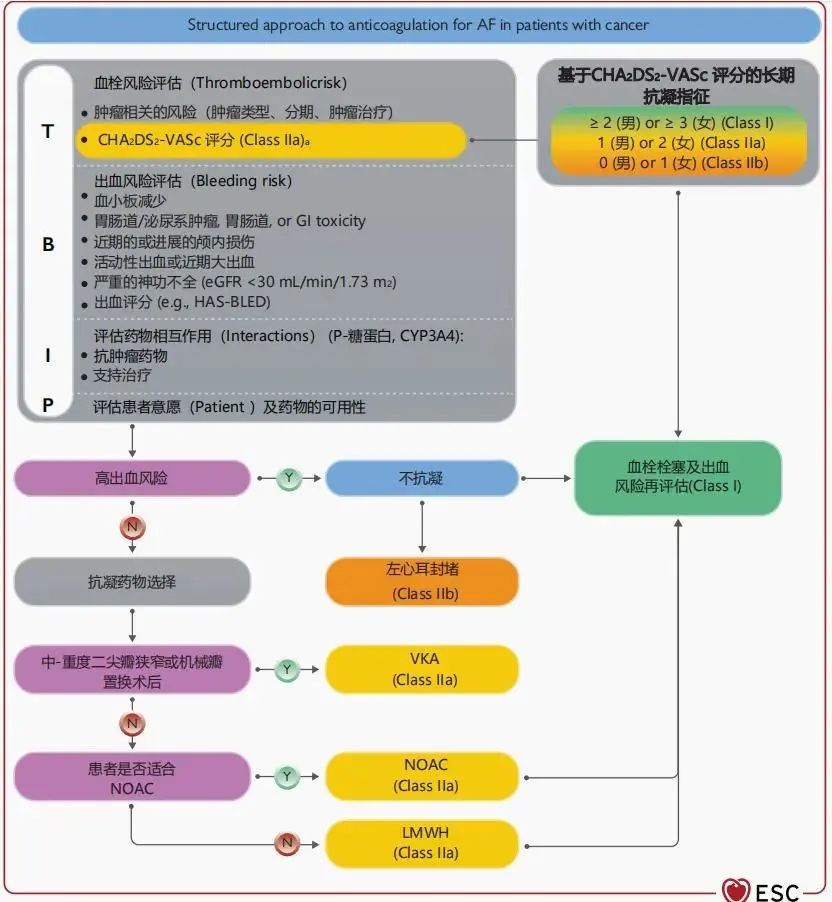
图14 房颤合并肿瘤患者抗凝管理流程
肿瘤治疗相关的室性心律失常(VA)的治疗应遵循一般人群心律失常管理指南。对于无症状的可自行终止的VA,一般无需停药,除非患者有其他心血管疾病危险因素或持续的心电图异常。对于有症状的VA,肿瘤治疗应减量或暂停,心脏科医生参与评估诊治。复发性危及生命的症状性VA需要紧急干预。IA、IC、III类抗心律失常药物常因药物相关作用及QTc延长的风险而应用受限。β受体阻滞剂和IB类抗心律失常药物的药物相互作用及QTc延长的风险较小时,如合并CTRCD,更推荐应用β受体阻滞剂。当患者合并结构性心脏病或血流动力学不稳定时,胺碘酮是首选药物。肿瘤治疗相关的很多室性心律失常与QT间期延长相关。在启动肿瘤治疗前,应评估基线QTc,纠正可逆诱因,且在肿瘤治疗过程中,应动态监测(图15)。
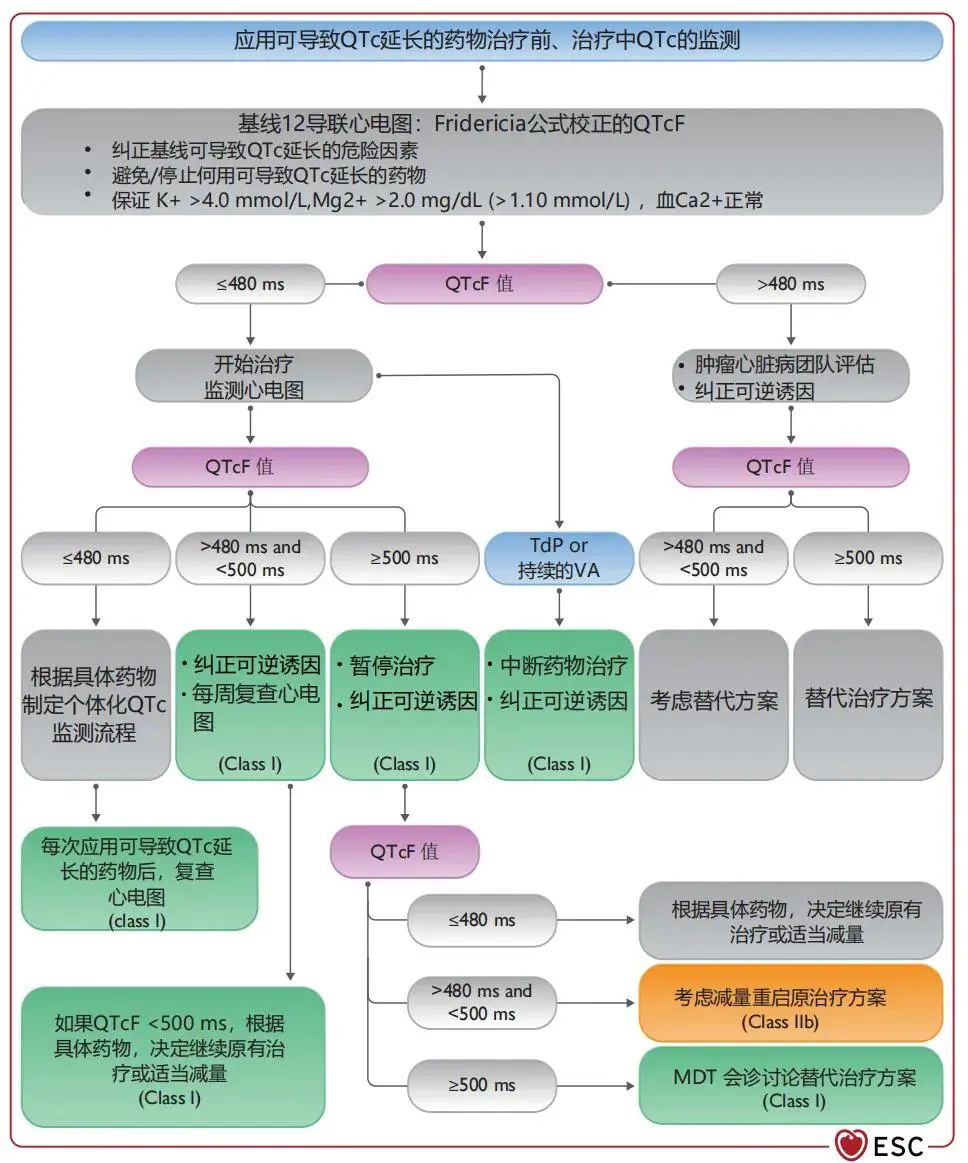
图15 肿瘤患者QT间期监测及管理流程
6. 高血压
肿瘤患者的动脉高血压可能是由抗肿瘤治疗(如VEGFi、第二代和第三代BCR-ABL TKI、布加替尼、伊布替尼、氟嘧啶、顺铂、阿比龙、比卡鲁胺、苯扎鲁胺)、非癌症药物(如糖皮质激素、非甾体抗炎药)和其他因素(压力、疼痛、过度饮酒、肾损害、未经治疗的睡眠呼吸暂停、肥胖和减少运动)引起的。对于动脉高血压的治疗管理如图16。指南对于不同情况下无症状高血压治疗的管理推荐如图17。
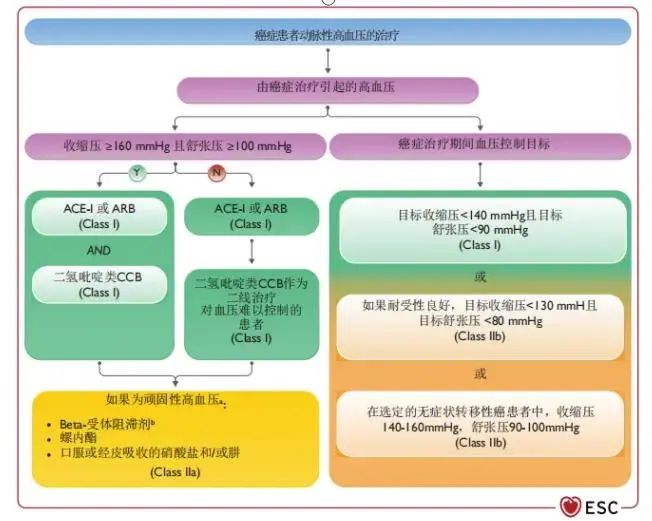
图16 癌症患者动脉性高血压的治疗流程
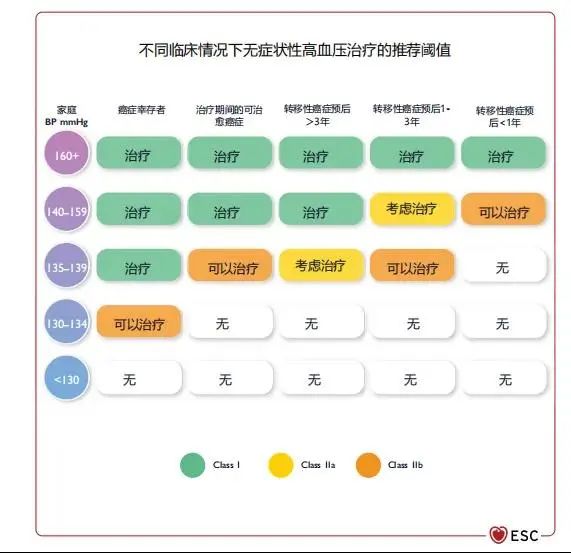
图17 不同情况下无症状性高血压治疗的推荐阈值
7. 血栓栓塞
血栓栓塞是肿瘤常见并发症。在肿瘤及其治疗期间发生的血栓栓塞事件包括静脉血栓栓塞(VTE)和动脉血栓栓塞(ATE),统称为肿瘤相关血栓形成。指南中总结了肿瘤患者发生静脉血栓栓塞事件危险因素(图18)及抗凝方法(图19)。
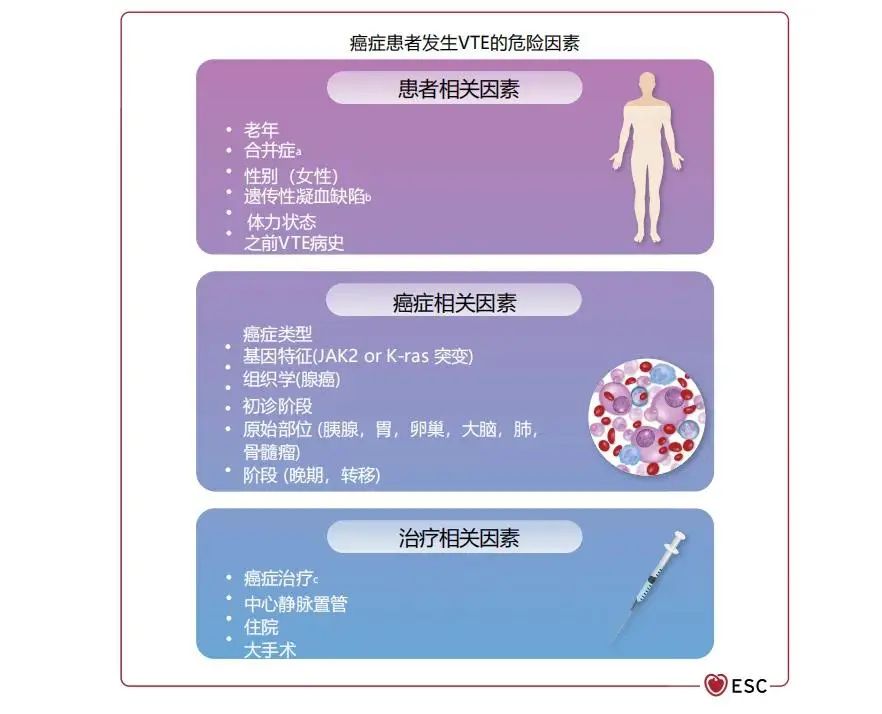
图18 癌症患者发生VTE的危险因素

图19 癌症患者静脉血栓栓塞的结构化抗凝方法
此外,指南对于急性、亚急性心血管毒性的诊断与管理,出血并发症、外周动脉疾病、肺动脉高压、心包疾病、心包炎、心包积液管理流程都有提及。
肿瘤治疗后心血管疾病风险评估应持续至肿瘤治疗结束后12个月。以下人群需在肿瘤治疗结束后进行长期随访:(1)基线HFA-ICOS风险评估的高风险或极高风险患者;(2)接受远期心血管毒性风险较高的肿瘤治疗患者;(3)肿瘤治疗期间出现中-重度的CTR-CVT;(4)超声心动图提示新发的心功能异常、心脏生物标志物新发升高或在治疗结束时(治疗后3个月或12个月)新发的心血管症状。
同时,指南对于抗肿瘤治疗终末期相关心功能不全的管理、抗肿瘤治疗终末期的心肺运动测试和体能评估、心脏康复的作用也都加以说明。
心血管毒性相关抗肿瘤治疗除了影响患者身体健康和心理健康外,还可能降低预期寿命和生活质量。抗肿瘤治疗结束后第一年的心血管评估决定了其是否需要进行长期的心脏科随访。
肿瘤对儿童患者晚期影响的国际指南建议应每年评估心血管风险并进行健康生活方式的教育;超声心动图检查的频率应取决于风险程度:对于中等风险儿童和青少年肿瘤幸存者,建议每5年一次;对于高危儿童和青少年肿瘤幸存者,应每2年一次。
对于无症状的成年肿瘤幸存者,为提高预期寿命和生活质量,在治疗结束后出现新发或持续的异常,需要长期监测(图20)。建议所有成年肿瘤幸存者每年均进行心血管风险评估,以优化心血管风险控制,促进健康的生活方式。
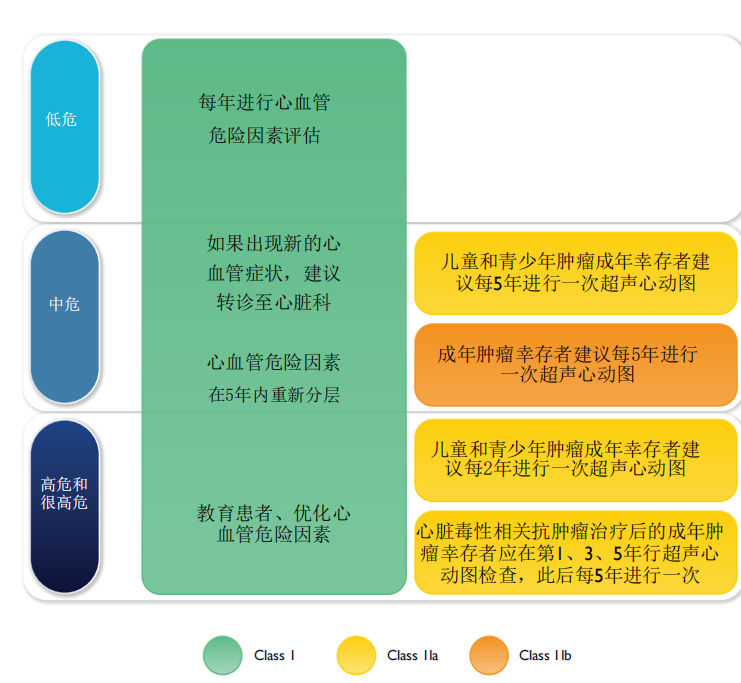
图20 无症状肿瘤幸存者的长期监测
轻链型淀粉样变是一种浆细胞疾病,可以与骨髓瘤同时发生,也可以单独发生,治疗上通常与多发性骨髓瘤(MM)相似,包括基于蛋白酶抑制剂(PI)的治疗。AL-CA的无创诊断基于临床怀疑、生物标记物、经胸超声心动图(TTE)、心脏核磁(CMR)和核素扫描。持续性肌钙蛋白升高和与TTE心脏功能参数不成比例的NT-proBNP升高(在没有肾功能衰竭或房颤的情况下通常为>300 ng/L)是AL-CA的特征性危险信号。心尖保留的整体纵向应变(GLS)降低是心脏淀粉样变的特异性表现,但无法区分ATTR-CA和AL-CA。此外,GLS≥−15%可作为AL-CA患者总体生存不良的独立预后因素。轻链型心脏淀粉样变诊断与监测的建议如表3所示。
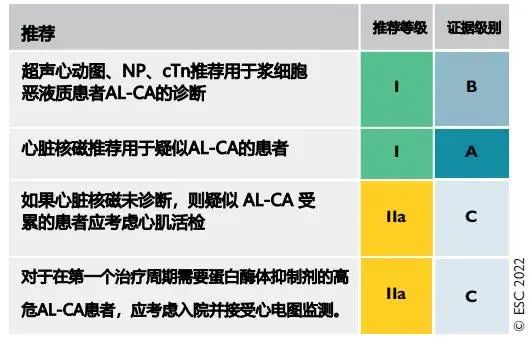
表3 轻链型心脏淀粉样变诊断与监测建议
指南中对心脏肿瘤、怀孕的肿瘤患者、类癌型心脏瓣膜病及心脏植入电子设备的管理均提出了相应推荐。
供稿:梁琳 黄丽燕 关敬元
审核专家:张宇辉