


FM,男性,72岁,既往有非缺血性心肌病病史,LVEF 45%,存在严重的睡眠呼吸功能障碍。最初治疗方案为夜间间断应用持续性正压通气(CPAP)及β受体阻滞剂、ACEI类药物治疗,并间断应用利尿剂。患者对CPAP及口服药物依从性较差,1个月未坚持治疗,出现劳力性呼吸困难、端坐呼吸困难、夜间阵发性呼吸困难和双下肢水肿。6min步行试验从4个月前的421m下降至现在的302m。复查超声心动图LVEF 30%。患者容量负荷增加考虑与左室功能下降、睡眠功能障碍有关,同时伴有呼吸困难、外周化学感受器和交感神经系统激活。随诊过程中患者出现心悸,心电图检查提示心房颤动,心室率103次/分(图1)。
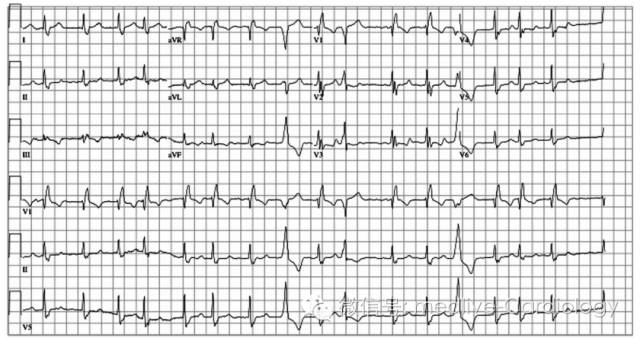
图1 心电图示心房颤动伴快速心室率、室性早搏。
探索新发AF的病因很重要,可能与以下多种原因有关(表1),不同患者发病原因与其基础病相关。患者左房压力升高主要与左室容量负荷增加及收缩功能下降有关,再次给予包括β受体阻滞剂、ACEI、利尿剂在内的改善心衰药物治疗及CPAP睡眠呼吸功能障碍。经过积极治疗后,尽管患者仍为房颤律,但心室率得到有效控制。
表1 心房颤动的发病原因及预测因素

对于心衰合并AF患者,控制心室率还是维持窦性心律是一个复杂的问题,没有明确证据表明哪种治疗方案更好。到目前为止,我们主要是依据较大规模研究中的相关数据来推断心衰合并AF的治疗,而这些研究入选的是AF患者,并不是AF合并心衰的患者。
根据目前的研究结果,选择维持窦性心律还是控制心室率必须根据患者的个体差异决定。维持窦性心律包括应用抗心律失常药物,这些药物具有明显的副作用,尤其对于老年患者。因此,在不应用抗心律失常药物情况下,心室率容易控制且控制达标的患者,以及不因AF症状限制的患者,控制心室率是更理想的选择。在控制心室率上,β受体阻滞剂和正确应用地高辛是安全且有效的,但是,非二氢吡啶类钙离子拮抗剂(维拉帕米和地尔硫䓬)有负性肌力作用,抑制心肌收缩,对于收缩功能下降的心衰患者有害,因此射血分数下降的心衰患者应避免应用。但是对于部分患者维持窦性心律是更好的选择,如控制心室率达标后仍有明显症状的患者、失去心房收缩后存在严重血流动力学障碍的患者以及在足量应用β受体阻滞剂或地高辛情况下心室率控制仍不达标的患者。
对上文报道的患者FM在经过治疗心衰的同时,滴定应用β受体阻滞剂,使静息心率控制在74次/分、活动后心率108次/分,尽管全身血容量状态得到改善,6min步行距离增加到354m,但仍存在乏力、心悸症状。故在此基础上应用电复律联合小剂量胺碘酮维持窦性心律。8周后,复查超声心动图LVEF升高至55%。
MK,男性,60岁,既往有高血压、高血脂、少突神经胶质细胞瘤切除术后及放疗病史,2年前行结肠镜检查时第一次被诊断为阵发性心房颤动。3月前,活动后出现呼吸困难,1周后症状加重,在当地医院就诊。诊断为心房颤动合并快速心室率,心室率为150~160次/分,并且合并心衰,给予呋塞米利尿及肝素抗凝治疗。超声心动图提示LVEF 30%,左室舒张末内径5.9cm,无明显瓣膜异常。该患者1年前曾行超声心动图LVEF 60%。
最初考虑为冠脉血管病变引起心衰,遂行冠脉造影术,结果提示前降支存在30%狭窄,其余冠脉血管管腔轻度不规则改变。甲状腺功能正常。给予华法林、琥珀酸美托洛尔(控制心室率和改善心肌重构)、赖诺普利治疗。12周后,MK因心棒、呼吸困难再次住院,当时静息心率为130次/分,收缩压为70mmHg。体格检查:颈静脉压为16cmH20(约为1568Pa),心尖冲动向左侧移位,奔马律,肺部听诊可闻及湿性啰音,双下肢水肿。复查超声心动图LVEF 10%~15%(图2)。加用更大剂量利尿剂,应用地高辛以改善心室率控制效果,增强心肌收缩 力。在优化药物治疗心衰基础上,植入双腔ICD。
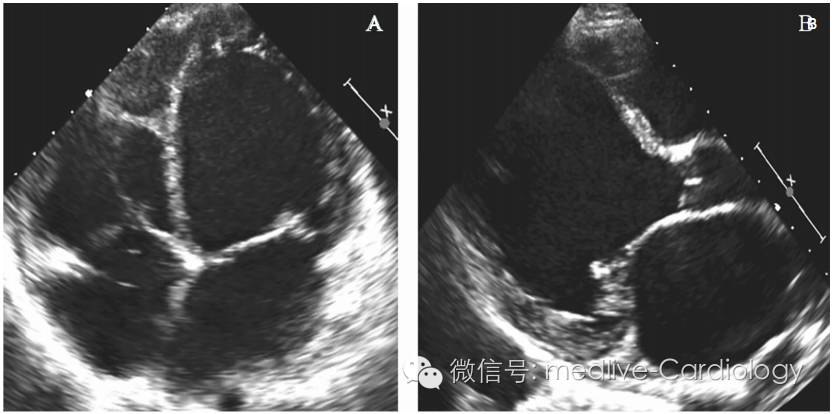
图2 超声心动图:心动过速介导的心肌病。(A)心尖四腔切面;(B)胸骨旁长轴切面。
在以后的复诊中,MK症状明显好转,但仍有轻度呼吸困难和持续的心悸症状。已行冠脉造影检查排除因心肌缺血引起的心衰,故AF为患者出现心衰的病因。在不应用美托洛尔和地高辛的情况下,静息心率为105次/分。体格检查:颈静脉压5cmH2O(约490Pa),第一心音强弱不等,各瓣膜听诊区未闻及杂音,心尖冲动正常。肺部听诊未闻及湿啰音,腹软无膨胀,双下肢无水肿,末端动脉搏动存在,四肢温暖。心电图提示心房颤动、非特异性T波异常改变。ICD程控过程中证实有持续性AF伴快心室率,心室率常在180次/分以上,现在排除了心肌缺血、内分泌、心脏毒性物质的影响,考虑MK为心动过速性心肌病。
心动过速性心肌病是一种常见病,正确认识它是非常重要的,选择充分控制心室率还是维持窦性心律对于左室功能的改善有很大意义。另外,心动过速性心肌病与其他疾病的鉴别也很重要,包括但不局限于缺血性心肌病,内分泌、毒性物质暴露、传染病、心肌炎等也可引起。在一项超过200例HF合并AF患者的研究中,推测30%存在心动过速性心肌病。对于植入心脏起搏器或ICD的患者,很容易通过程控获得心律不齐和心动过速情况,没有植入上述装置的患者,动态心电图及心外循环记录仪对诊断也很重要,从中可以知道哪段时间发生了AF以及静息心率与活动后心率的波动范围。
收缩功能下降的心衰患者,在心室率控制很难达标的情况下,维持窦性心律可能是更有效的选择。心衰合并AF患者维持窦性心律需要仔细观察患者的病情变化。选择维持窦性心律意味着应用抗心律失常药物。2011年美国AHA/ACC/HRS指南明确提出胺碘酮、多非利特可作为心衰合并AF患者节律控制的一线用药。这两种药都是III类抗心律失常药物,有阻断钾通道及延长心房肌、心室肌动作电位时程,延长复极时间及有效不应期的作用。欧洲心脏病协会尽管没有强调多非利特的一线治疗,但同样将胺碘酮作为一线用药。众所周知,胺碘酮对多器官存在毒性作用,如甲状腺、肝脏、肺、皮肤和神经系统。长期应用胺碘酮的患者,这些副作用很可能出现。除上述药理学特点外,胺碘酮有自身的优势,如基本不存在负性肌力作用,与同类的其他抗心律失常药物相比基本不存在延长QT间期及致心律失常作用。胺碘酮的另一个优势是有抑制β受体的作用,可以延长房室结不应期,AF复发后心室率较容易控制。CHF-STAT研究发现胺碘酮可能对LVEF≤40%且室性早搏>10个/时的充血性心衰患者有益。
决奈达隆与胺碘酮的化学结构及药理作用相似(不含与胺碘酮副作用相关的碘),禁用于NYHA心功能分级III~IV级的心衰,也不提倡应用于加重的II级心衰患者。另一种III类抗心律失常药物——索他洛尔,应用于心衰时,也应谨慎,它可以延长QT间期,使尖端扭转型室速的发生率明显增加,用药初期也需密切观察、随时监测。索他洛尔也有抑制β受体的作用,与其他β受体阻滞剂合用时,加重心衰失代偿期相关的房性心律失常的临床症状,增加存在器质性心脏病患者的容量负荷。
IC类抗心律失常药物是钠通道阻滞剂,可降低动作电位0相上升速度和幅度。氟卡尼和普罗帕酮都属于IC类抗心律失常药物,在心室舒张期阻断钠通道(减慢传导),对于心率加快引起的舒张期缩短有很大改善作用,因此,IC类抗心律失常药物广泛应用于室上性心动过速。然而,这些药物会增加心衰不良事件的发生,它们存在负性肌力作用可加重心衰,尤其对于NYHA心功能分级III~IV级的患者。普罗帕酮增加肺毛细血管楔压、体循环阻力、肺循环阻力,减少心脏输出,禁用于症状明显的心衰患者。应用于轻度的左室收缩功能下降和无明显症状的心衰患者是安全的,但需谨慎应用,严密监测。应用于这些人群前需考虑IC类抗心律失常药物增加心源性猝死风险,必须通过冠脉造影或负荷试验排除缺血性心肌病。
尽管抗心律失常药物是AF患者维持窦性心律的一线用药,但通常不能使患者长期获益,可以考虑长期有效的有创治疗方法。房性心律失常起源于肺静脉,可通过射频消融术电隔离异常兴奋灶根治房性心律失常。
药物治疗不能成功者,可选择替代治疗,除射频消融隔离肺静脉外,另一种方法为消融房室结后植入心脏起搏器。对于心衰患者,右心室起搏导致心室的不同步可加重心衰,尤其起搏比例>40%者。因此,房室结受损和出现高度房室传导阻滞时,应考虑植入CRT,使左右心室同时起搏。同样,CRT可能使心衰合并AF患者获益,消融房室结可阻断自身的快速房室传导,降低自身起搏发生,以避免自身起搏影响再同步化效果。
—心肌淀粉样变性
LD,男性,67岁,既往脑卒中病史,考虑脑缺血或自发性血栓形成引起。现神经系统症状已恢复,但仍有活动后乏力,再次就诊时出现新发的心房颤动。超声心动图及多普勒超声提示:LVEF正常,左室舒张功能下降,左室中度肥厚,室间隔非对称性增厚,双房扩大,轻度肺动脉高压。诊断基本排除肥厚性心肌病,给予β受体阻滞剂和利尿剂治疗。除此之外,患者仍有严重的活动后乏力症状,仅能在室内行走,并且出现双下肢水肿。尝试应用抗心律失常药物氟卡尼及索他洛尔转复AF,但不能维持窦性心律。复查超声心动图及多普勒超声:左室收缩功能保留,但病情加重,双心室扩大、室壁变薄,严重的右室功能不全,严重的左室舒张功能下降伴二尖瓣反流,肺动脉压较前明显升高达105mmHg(图3)。体格检查:血压118/68mmHg,心率67次/分,颈静脉压20cmH20(约1960Pa),肝颈静脉回流征阳性,可闻及第4心音,二尖瓣收缩期杂音,右肺呼吸音减低,右侧胸腔积液,双下肢对称性水肿 。
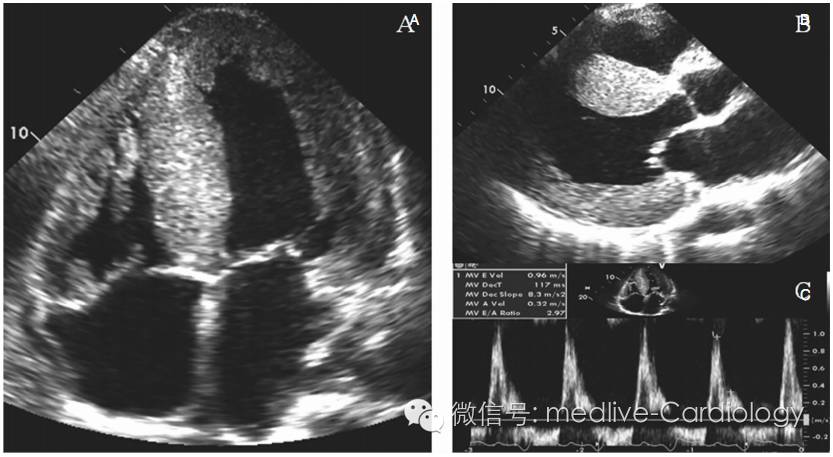
图3超声心动图:心肌淀粉样变性。(A)心尖四腔切面;(B)胸骨旁长轴切面;(C)限制性多普勒表现。
分析患者存在双室增厚、心肌受限、胸腔积液,推测患者为淀粉样心肌病。血液、尿液中轻链蛋白水平升高,骨髓活检提示35%为浆细胞。取脂肪组织切片进行刚果红染色,也证实患者为免疫性轻链蛋白型淀粉样心肌病。初始给予硼替佐米和地塞米松治疗,后加用来那度胺,治疗期间如双下肢水肿加重则加量利尿剂。
在滴定应用抗心律失常药物情况下,患者仍为持续性心房颤动,故行射频消融术隔离肺静脉,术后3个月再次出现AF,再次行射频消融术。第二次消融术后继续应用抗心律失常药物氟卡尼,但仍为房颤律。维持窦性心律效果差,停用抗心律失常药物,治疗焦点转为控制心室率,在能耐受情况下滴定应用β受体阻滞剂(琥珀酸美托洛尔)。
这个病例重点强调了心衰患者出现AF后的不同治疗方案选择,与之前介绍的病例不同,这是一个射血分数正常的淀粉样心肌病患者合并AF病例。对近900例年龄>65岁患者进行观察,4年后发现舒张功能下降者发生AF的风险较舒张功能正常者明显增加。总的来说,射血分数正常的心衰患者合并AF的治疗策略与心脏收缩功能下降者相似,同样为心室率和维持窦性心律两种,不同之处在于非二氢吡啶类钙离子桔抗剂的应用,因存在负性肌力作用,心脏收缩功能下降时应避免应用,对收缩功能正常的心衰合并AF患者应用是安全的。事实上,非二氢吡啶类钙离子拮抗剂如维拉帕米、地尔硫䓬可降低心肌收缩力,减轻心室输出阻力,对肥厚型心肌病有一定改善作用。
此外,AF抗凝治疗也是一个重要的问题,尤其是存在血栓形成高风险的患者,如合并心衰,更应重视抗凝治疗。大部分心衰合并AF患者有抗凝指征,抗凝可降低心源性血栓形成的风险,这对射血分数正常与否的患者均适用。上面所描述的病例只代表部分存在心房内血栓形成高风险的心衰患者,淀粉样改变浸润心肌,引起心房功能异常,出现心房内血液停滞,这种改变即使在窦性心律时也可发生。心肌淀粉样变性使窦性心律时心房功能减弱,不能进行有效收缩,A峰多普勒超声流速降低,二尖瓣环组织多普勒超声流速降低。目前常用CHADS2评分评估是否进行抗凝治疗,CHADS2评分是一项简单的基础评分,包括了已经被研究验证的5种危险因素。最新的评分标准为CHA2DS2-VASc评分。
抗栓药物的选择也很重要,目前包括抗血小板、抗凝两种。已经证实抗血小板药物阿司匹林和氯吡格雷可预防血栓形成引起的脑卒中,但是与单独应用阿司匹林、阿司匹林联合氯吡格雷和小剂量华法林联合阿司匹林3种治疗方案相比,单独应用华法林的效果最好。血栓形成低风险的患者,可将阿司匹林作为脑卒中的一级预防用药,需要指出的是,这一般不适用于存在心衰的患者。对于不能进行定期监测的患者,可以选择口服直接凝血酶抑制剂,目前这已经作为基础治疗。
小结
随着心衰发病率的增加,针对心衰病因及其并发症的有效治疗可降低再住院率及死亡率。AF是心衰最常见的并发症之一,它既是导致心衰的重要机制之一,也是继发于心衰的一种并发症。对不同患者新发心衰与新发AF的详细评估十分重要,两者密切相关。
关于心衰合并AF的治疗,目前没有明确证据表明控制心室率与维持窦性心律孰优孰劣,应针对个体差异选择对患者更好的一种治疗策略;但是,维持窦性心律时,部分情况下应用抗心律失常药物与心衰相矛盾,如存在器质性心脏病、有明显的失代偿期症状和体征及存在缺血性心肌病等,以上情况可影响抗心律失常药物的安全性,从而限制其应用。对药物控制心室率与窦性心律均不佳者,可选择射频消融术,治疗方法为隔离肺静脉或消融房室结后植入心脏永久起搏器。
抗栓治疗是心衰合并AF的另一个重要问题,对预防全身性血栓形成有很大益处。临床医生在选择口服阿司匹林、华法林或是直接凝血酶抑制剂时,应充分考虑个体差异性,如血栓形成风险、用药习惯、药物相互作用、出血风险等。事实上,AF与心衰是存在关联的两种常见病,各自治疗时可能是另一种疾病的征兆。