

临床终点委员会(CEC)在临床试验终点事件的判定过程中具有重要作用。CEC可以通过减少偏差及提高准确性,来提高研究结果的有效性,在国际临床研究中的应用已非常普遍1。Tyl等人使用CEC裁定终点的方法,对十年前SHIFT研究结果再次进行了验证。
CEC裁定终点的重要作用
临床终点事件的识别对于临床研究过程的完整性至关重要。在前瞻性研究中,尽管预先定义了结局指标,但独立审查者之间仍可能出现分歧,给终点评估带来了不确定性。因此,许多前瞻性临床试验使用CEC进行裁定2。
CEC是一个由相关研究领域专家组成的独立委员会,在临床试验中负责对终点事件进行裁定,避免中心与中心之间事件判定的偏差,以达到更准确地评估试验结果,是临床试验质量控制的关键环节之一1。大型临床试验往往涉及多个中心,而不同中心以及不同研究者对终点的判定并不一致,采用CEC对事件进行统一判定则不失为一种更规范的方法1。
CEC裁定终点通常用于支持包括心血管疾病在内的所有治疗领域的药物批准3。目前,包括欧洲药品管理局(EMA)4,5,和美国食品和药品管理局(FDA)6在内的监管机构建议在随机对照试验中对终点进行集中裁定。
CEC裁定终点在SHIFT研究中的应用7
SHIFT是一项随机、双盲、安慰剂对照研究,以评估伊伐布雷定对心衰患者的心血管死亡或心衰恶化住院事件的影响(图1)。研究者(所有心脏病专家)报告预定终点及导致死亡和住院的原因。CEC由在心衰和裁定程序方面经验丰富的7位心脏病专家组成,对所有预定终点进行了审查和裁定。

图1 SHIFT研究设计
研究人员确定了7529个预定终点,CEC确定了6793个终点(表1),事件数差异对研究结果无显著影响。研究者和CEC确定终点的危险比(HR)相似,分别为0.83(95%CI 0.76-0.91)和0.82(95%CI 0.75-0.90),主要终点的每个组成事件的结果也相似(心血管死亡的HR分别为0.92和0.91;心衰恶化住院的HR分别为0.78和0.74)(图2)。
表1 研究者报告和CEC确定的事件数
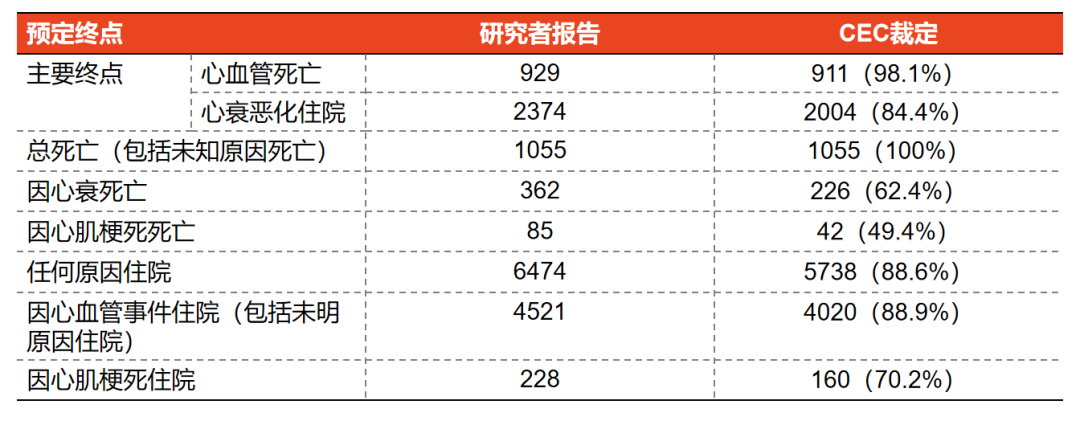
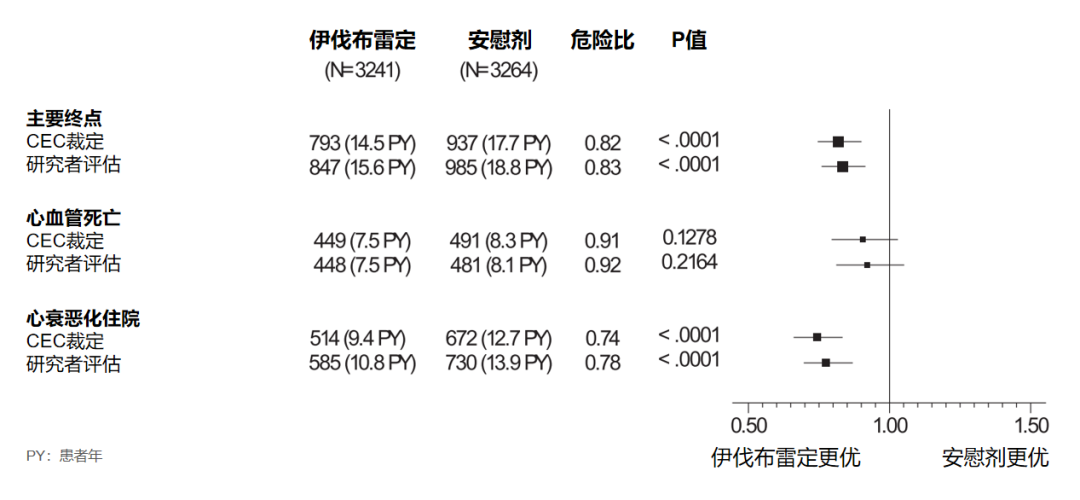
图2 CEC裁定或研究者评估的主要终点及其组成事件的危险比
CEC裁定终点对SHIFT
研究结果的影响讨论
CEC的应用能改变许多主要终点的判定结果,然而在某些临床试验中,CEC的判定对研究结果并无显著影响1。这是因为CEC对终点准确性的提高,主要基于其可以排除无效事件,消除干扰因素,分辨治疗效果8。采用明显有效疗法且事件数较多的大型试验将具有充分的能力证明研究中治疗方案的效果,不太可能在基于CEC裁定或研究者报告的事件分析中显示出重大差异。换言之,在这些试验中,由无效事件引起的干扰因素可能影响不大。相反,对于事件数较少且治疗效果较弱的研究,更易产生干扰因素,使疗效评估精确性降低。因此,SHIFT研究作为一项事件数较多且具有明确治疗效果的大型试验,CEC裁定终点与研究者报告事件相比,主要结果差异不大。
然而,有些研究则反之。例如,PARAGON-HF研究9比较了血管紧张素受体脑啡肽酶抑制剂(ARNI)与血管紧张素受体阻滞剂(ARB)在射血分数保留型心衰(HFpEF)患者中的疗效,结果显示,由于疗效的效应值不大,即使研究者报告终点显示两组事件差异有统计学意义(1064 vs 1241; HR 0.84, 95%CI 0.74-0.96; P=0.028),但通过CEC裁定后,两组事件差异无统计学意义(894 vs 1009; HR 0.87, 95%CI 0.75-1.01; P=0.059),即CEC改变了该研究主要终点的判定结果。
小 结
通过CEC裁定终点方法,可提高研究结果的准确性。在SHIFT研究中,与研究者报告终点相比,CEC集中裁定终点得到的最终结果无显著变化7。提示SHIFT研究结果可靠,伊伐布雷定治疗心衰患者的疗效明确。
参考文献
1.王彩虹, 等. 中国循证医学杂志. 2013;13(10):1269-1272.
2.Petersen JL, et al. Contemp Clin Trials. 2006;27(3):260-268.
3.Stuck AK, et al. J Clin Epidemiol. 2014;67:278-284.
4.European Medicines Agency. https://www.ema.europa.eu/documents/scientific-guideline/guideline-clinical-investigation-medicinal-products-treatment-chronic-heart-failure-revision-2_en.pdf. Accessed January 31, 2019.
5.European Medicines Agency. https://www.ema.europa.eu/documents/scientific-guideline/guideline-clinicalinvestigation-new-medicinal-products-treatment-acute-coronary-syndrome-first_en.pdf. Accessed January 31, 2019.
6.Farb A, et al. Am Heart J. 2017;191:62-64.
7.Tyl B, et al. Circ Heart Fail. 2020;CIRCHEARTFAILURE119006720.
8.Petrie MC, et al. Circ Heart Fail. 2020;CIRCHEARTFAILURE120007209.
9.Solomon SD, et al. N Engl J Med. 2019;381:1609-1620.
审阅专家:张宇辉
责编:冯佳禹