

心衰时的心肌代谢障碍
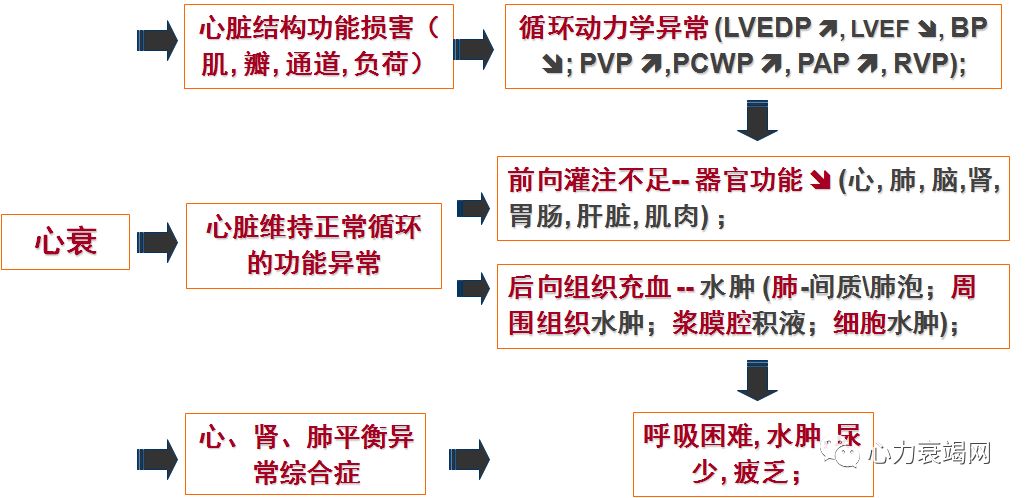
➤ 心衰时的心脏重塑:代偿性、适应性、病理性以及治疗性改变,后期是失代偿表现;部分重塑是可逆性的,有一定程度恢复和逆转的可能;
心脏形态、结构重塑 - 物理重塑;
神经内分泌重塑 -化学重塑
亚心肌细胞成分重塑 – 分子重塑(重要的能量重塑)

心脏持续性搏动,需大量和持续能量供给,健康人通过对不同底物代谢产能,并根据心脏状态、底物供给等,调整底物的选择和利用 ;
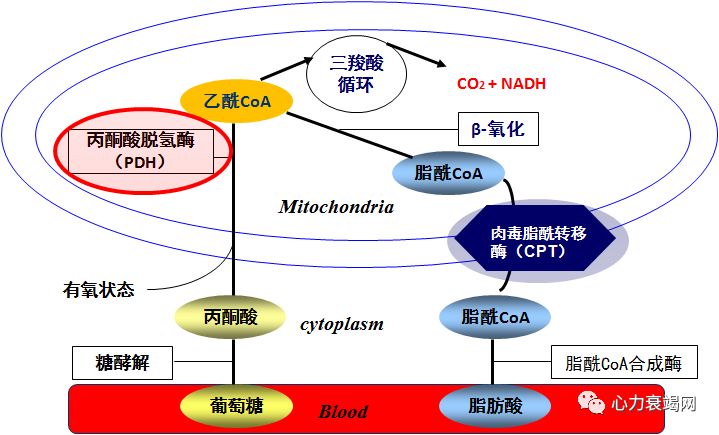
脂肪酸提供 60%的能量,其余40%由葡萄糖、乳酸、酮体、氨基酸供给;心肌细胞内贮备能量能力弱,需时时产能;
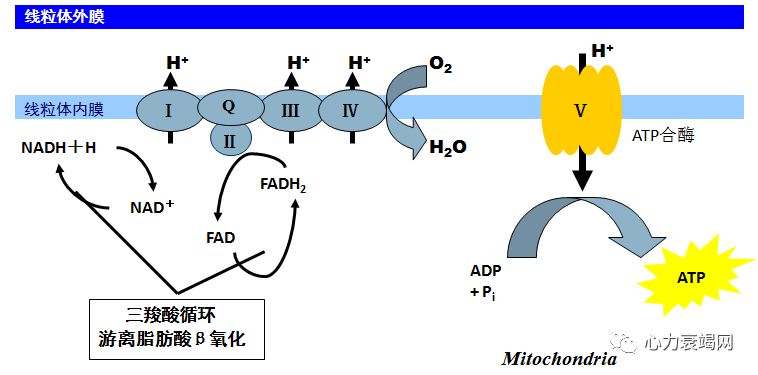
95%的能量由线粒体氧化产生;其中的 60-70%来源于脂肪酸氧化,其余来自其他物质的氧化;5%来自非氧化的葡萄糖酵解;
Canadian Journal of Cardiology 33 (2017)
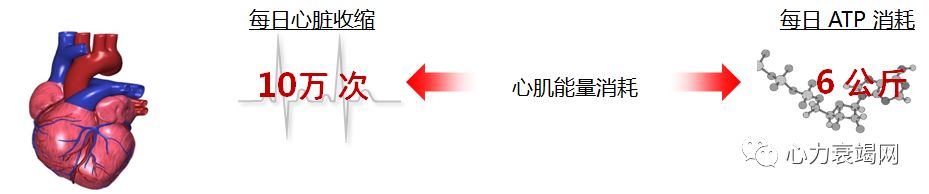
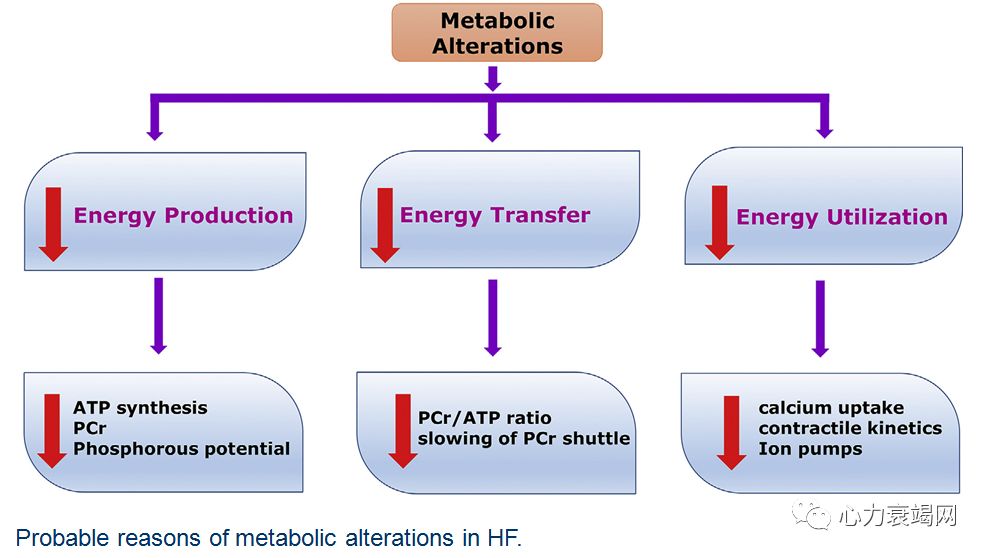
心脏耗能居所有器官之首,但心脏能量的储备却极少,成年心室组织 ATP 约为 5μmol/g, 仅维持 50 次心跳
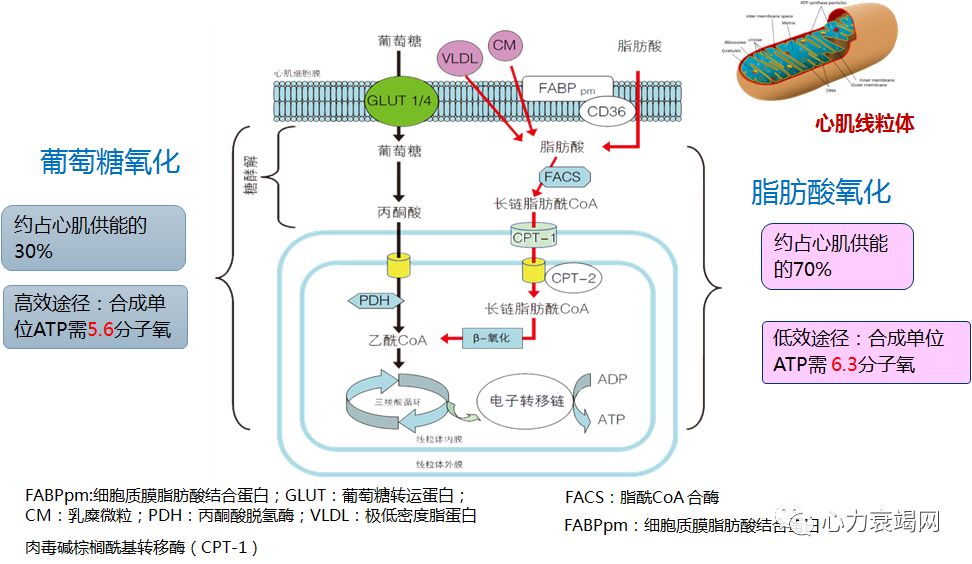
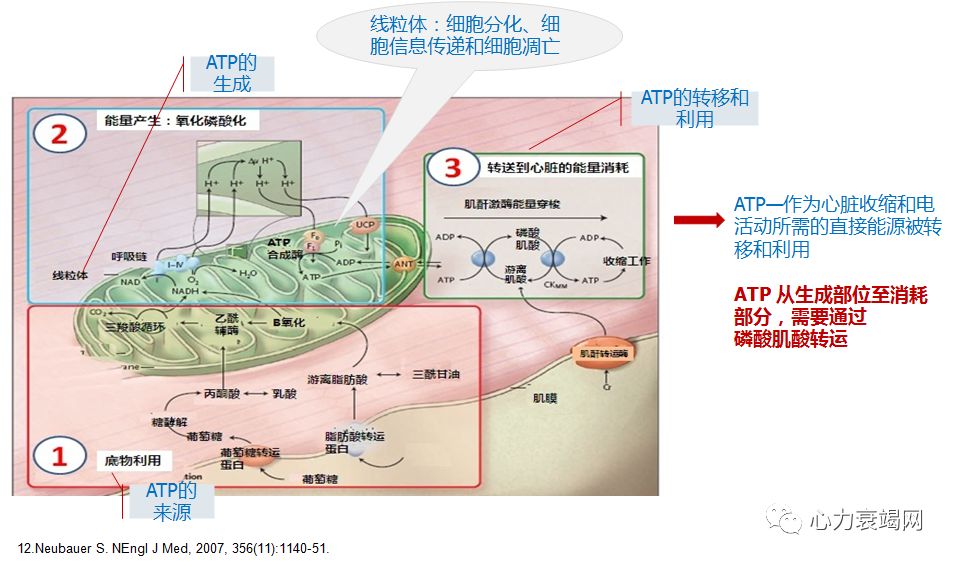
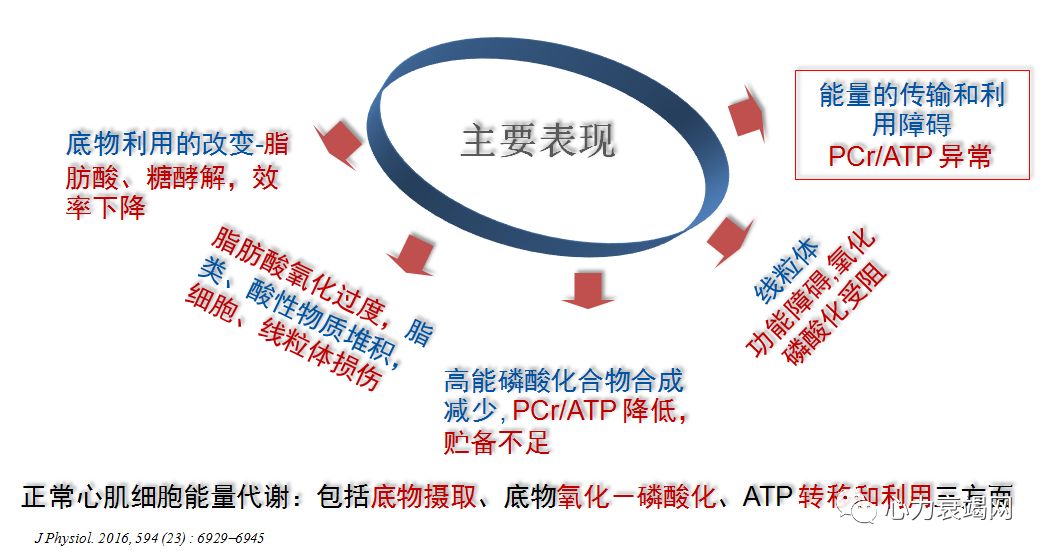
虽然心衰时不一定存在严重的组织缺氧,但由于心衰时氧气的消耗增加、毛细血管减少、血流缓慢等,多数存在“绝对”或“相对”的缺氧;加之心肌能量缺乏,ATP 产量降低 30-40%;
衰竭心肌摄取、利用、产生能量的效率显著下降;其中线粒体结构、功能的改变,心肌参与能量代谢(线粒体内、线粒体外)的各个程序、蛋白酶发生重塑,决定里心肌细胞能量代谢的重塑;还有 转运、利用等环节….
❈ 1.心衰时线粒体功能损害
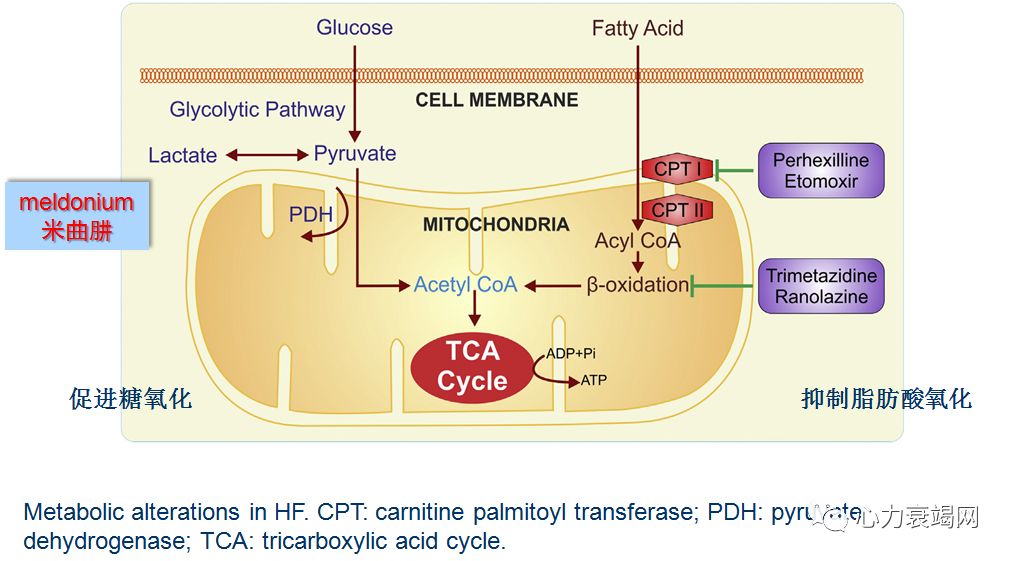
线粒体氧化能力下降,代谢方式返回新生儿阶段-糖酵解,适合低氧状态但效能极低。衰竭心脏的 ATP 含量仅为正常人 30-40%;
上述机制促进了糖酵解的代偿机制,导致糖酵解与糖氧化间的严重失衡
❈ 2.线粒体生物合成和脂肪酸氧化的转录水平调控能力下降
❈ 3.活性氧增加
❈ 4.心肌细胞的持续性线粒体自噬增加, 凋亡增加;
上述因素促进了线粒体氧化能力下降, 和其后的ATP 合成下降。但对于底物氧化能力的下降是不同的,受心衰类型 HFpEF or HFrEF的影响
❈ 5. 心衰时,代偿性的糖酵解增加,并与糖氧化的平衡严重紊乱
增加了葡萄糖转运体-GLUT 的表达;
增加的糖酵解,并不能够补偿能量缺乏;糖酵解中,每个葡萄糖分子仅产生 2 个ATP 分子,而氧化产生 31 个 ATP 分子;
增加的糖酵解还与丙酮酸和乳酸的氧化不匹配,导致胞浆中氢离子的大量堆积;
导致钙离子的堆积。
因此,诱导并改善糖氧化途径,是心衰治疗的重要战略,可以改善甚至逆转心衰的结构和功能损害
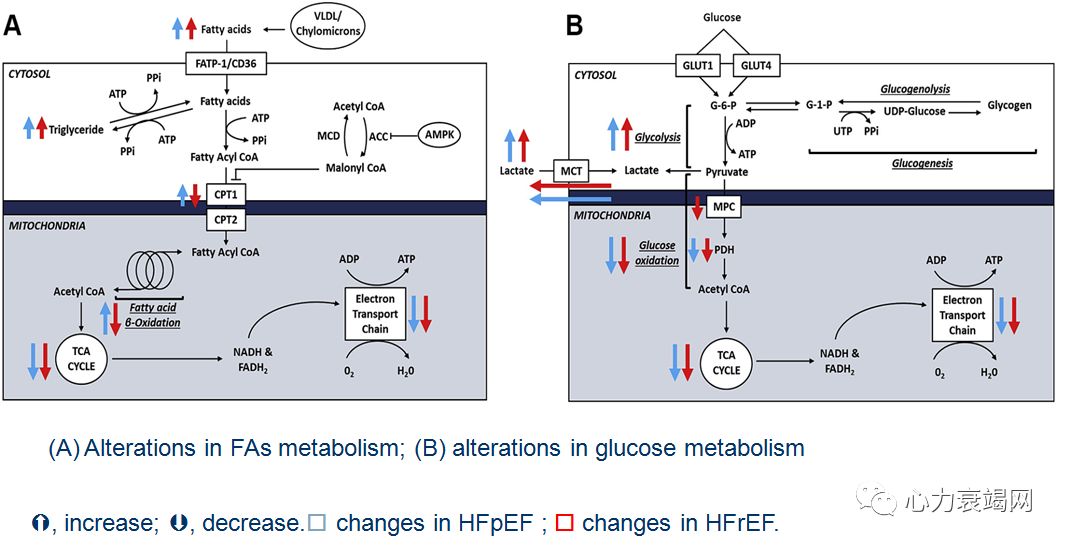
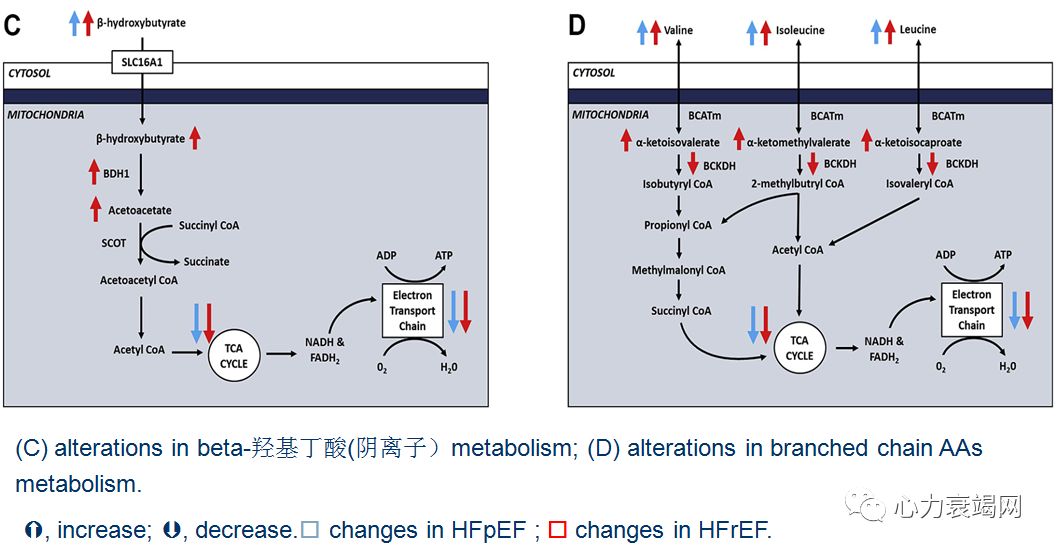
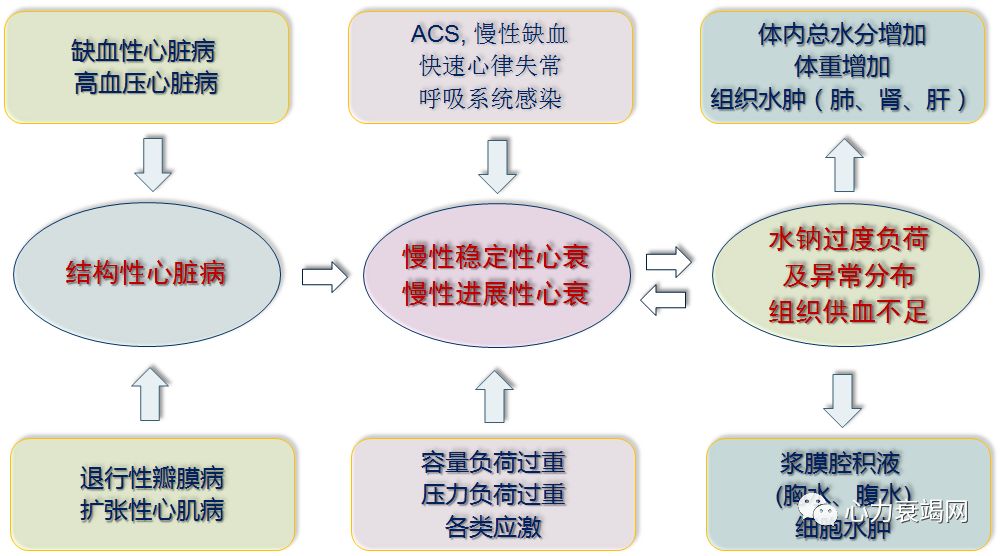
心衰时,能量代谢的变化是多样的、复杂的;
HFpEF:➘葡萄糖氧化,➚葡萄糖酵解和 FA 氧化.
HFrEF:➘FA 氧化、葡萄糖氧化、BCAA 氧化;➚葡萄糖酵解和酮体氧化.
HFpEF和HFrEF共有的代谢缺陷:➘葡萄糖氧化,降低了心脏能量代谢的效率和心脏的功能;
提高葡萄糖氧化,可作为治疗 HFpEF和HFrEF 心衰时的战略之一

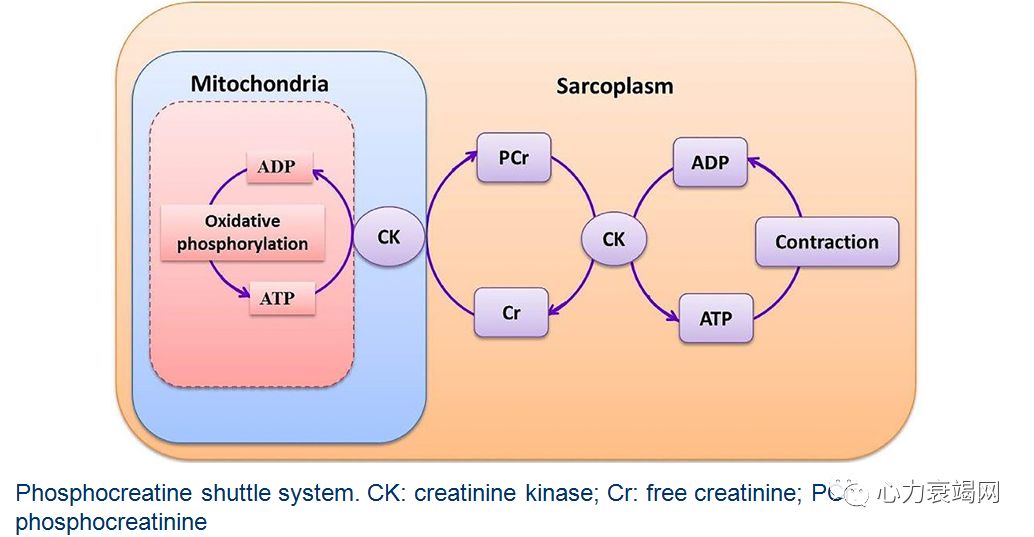
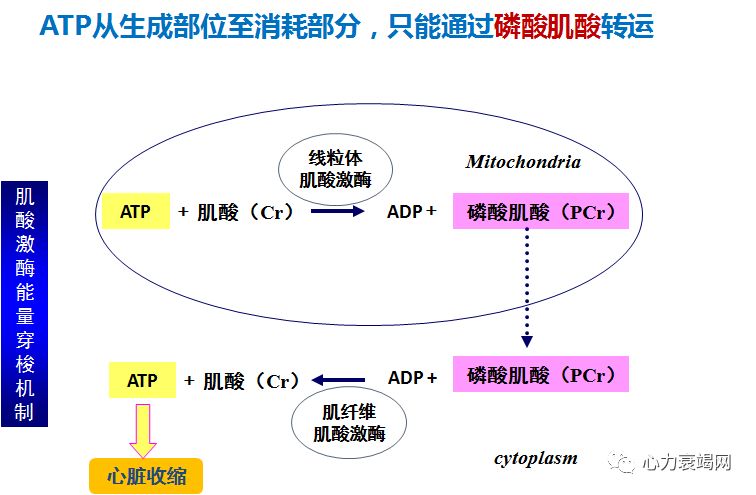
磷酸肌酸
-心肌能量代谢过程中的重要物质
作用:补充到心脏中的 Cr,利用 ATP交出的Pi ,形成 PCr并以这种化合物,作为心脏能量贮备和转运的形式
❈ PCr一种内源性物质,是哺乳动物体内主要的高能磷酸化合物,存在于心肌及骨骼肌中
PCr 12000卡/mol
ATP 7300卡/mol
ADP 3800 卡/mol
❈ PCr是心脏内可被迅速动用的能源储备
在心肌细胞内ATP 浓度是靠 PCr的消耗来维持稳定,PCr还是三羧酸循环产物的“接手”
当心肌缺血时,早期少量 ATP减少发生在大量PCr减少之前,即先消耗PCr来维持ATP浓度-快速的再磷酸化
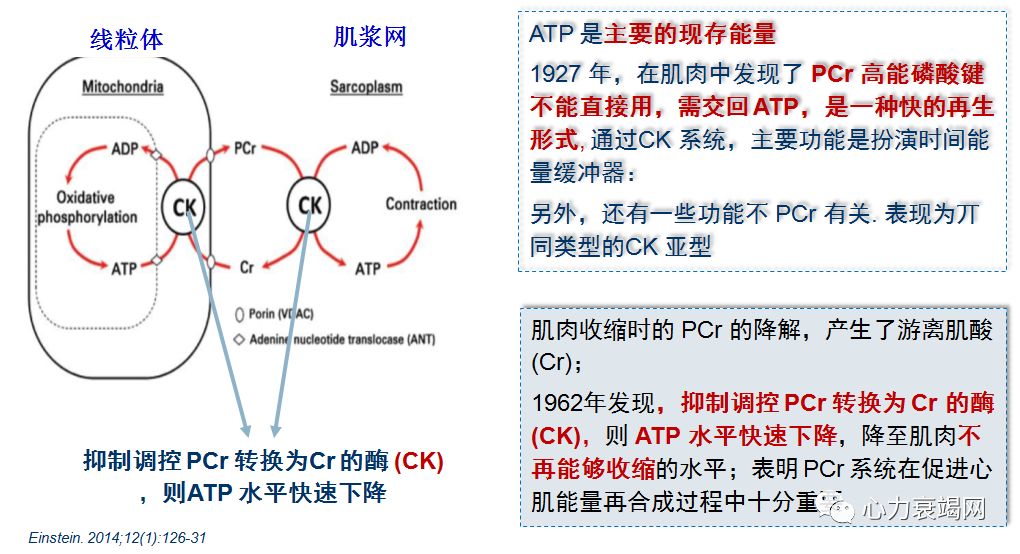
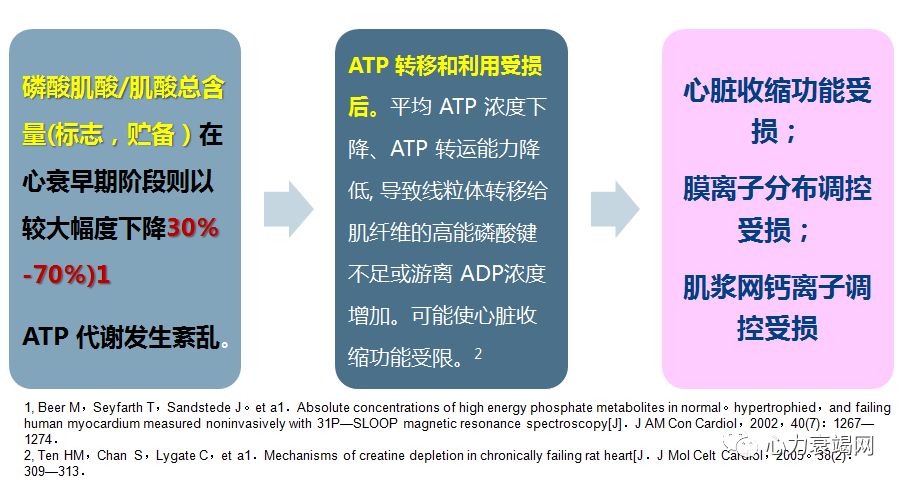
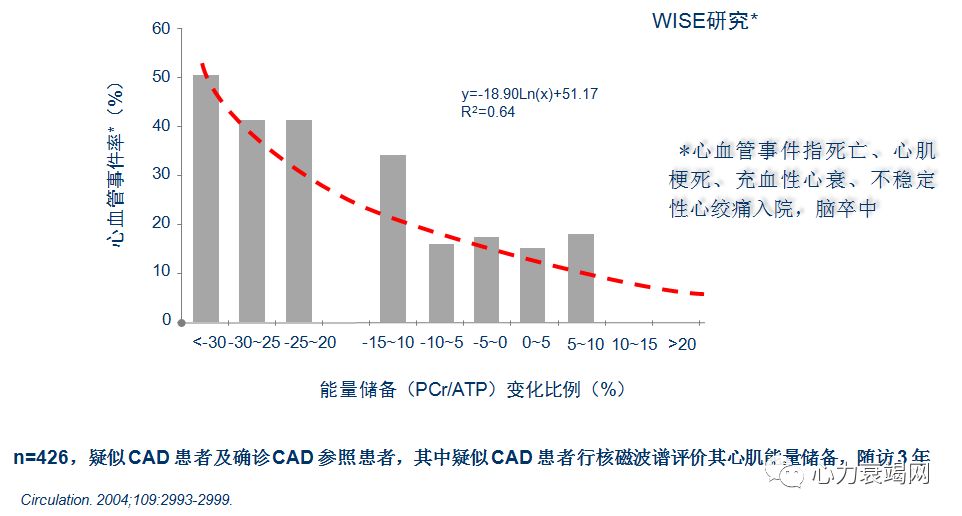

不论PCr减低,是原因还是结果,均表示一个不利的不良预示信号
PCr/ATP 比值下降,是扩张性心肌病、其他心脏病死亡的强预测因子
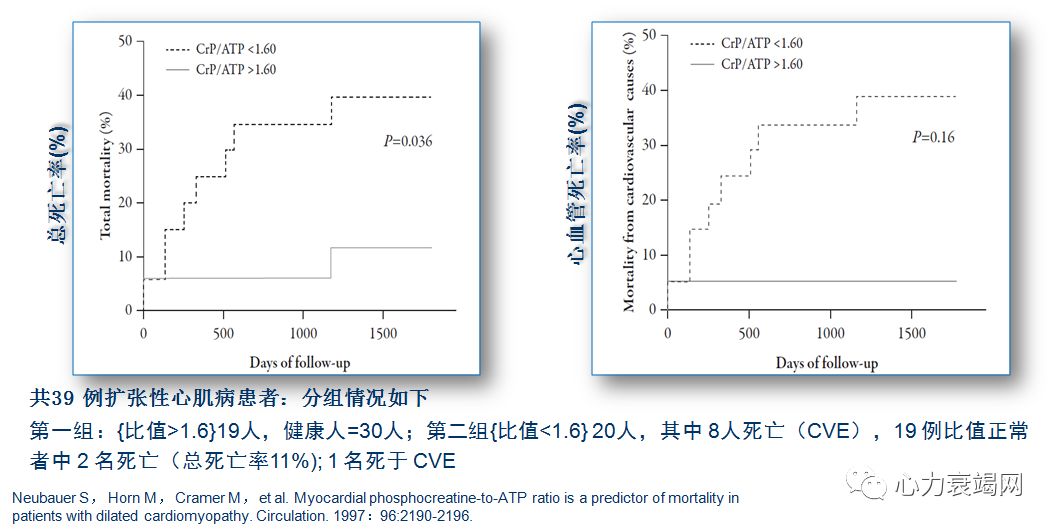
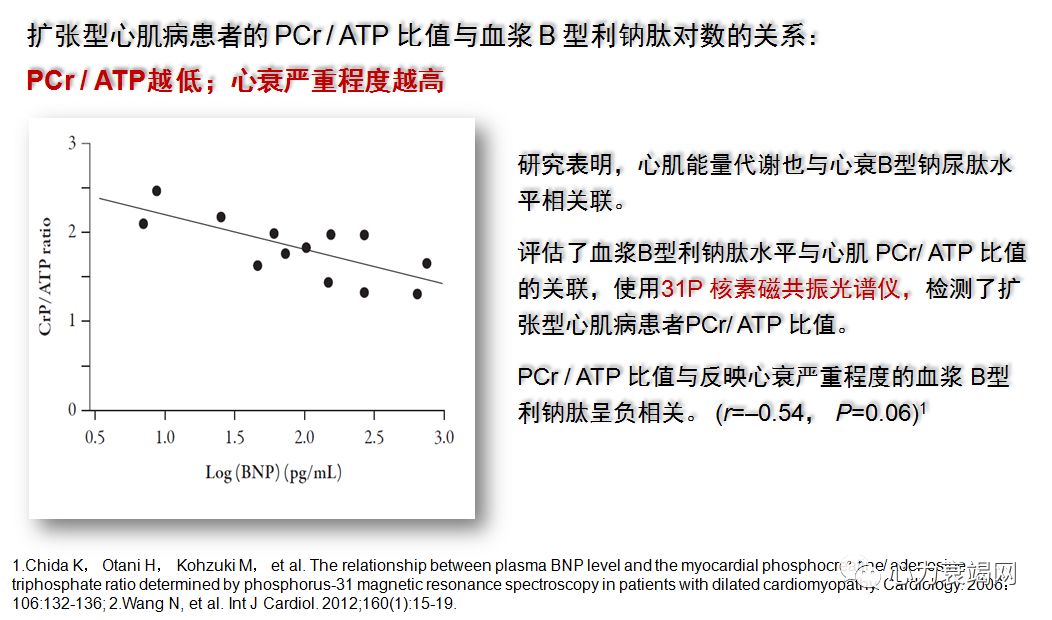
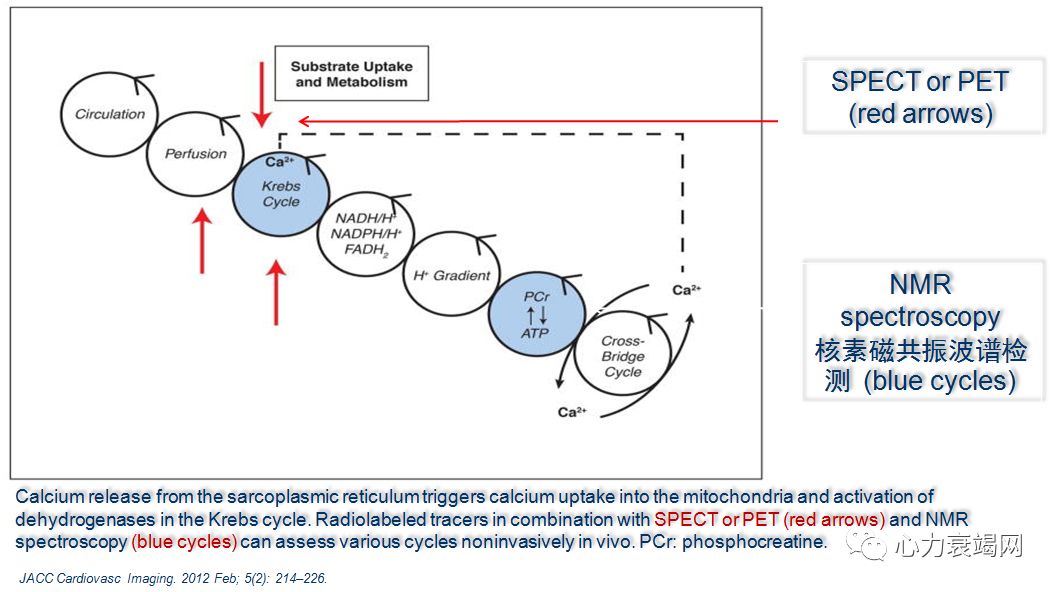
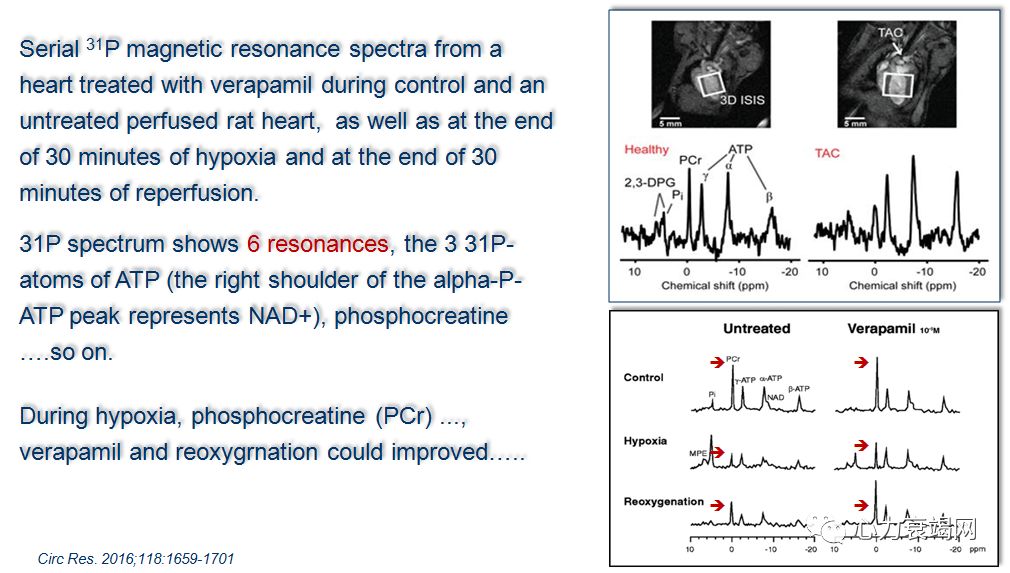
31磷磁共振波谱 (31P MRS) ,唯一工具评价人心肌高能磷酸HEP (high-energyphosphate)体内代谢的工具;
心肌 HEP 代谢表现为代谢的稳定性,以便在负荷增加时,维持持久的PCr和 ATP的水平平衡;
PCr/ATP 比值,反映肌酸再磷酸化率 (creatinerephosphorylation rate) 和心肌细胞的线粒体功能
31P MRS 研究显示,在各种结构性心脏病(先心病、心肌病、心衰)、心血管代谢性疾病(心肌缺血、CAD、DM) 时,心脏 PCr/ATP 比值显著下降,不具病因特异性
PLoS ONE. 2016, 9(6): e97368
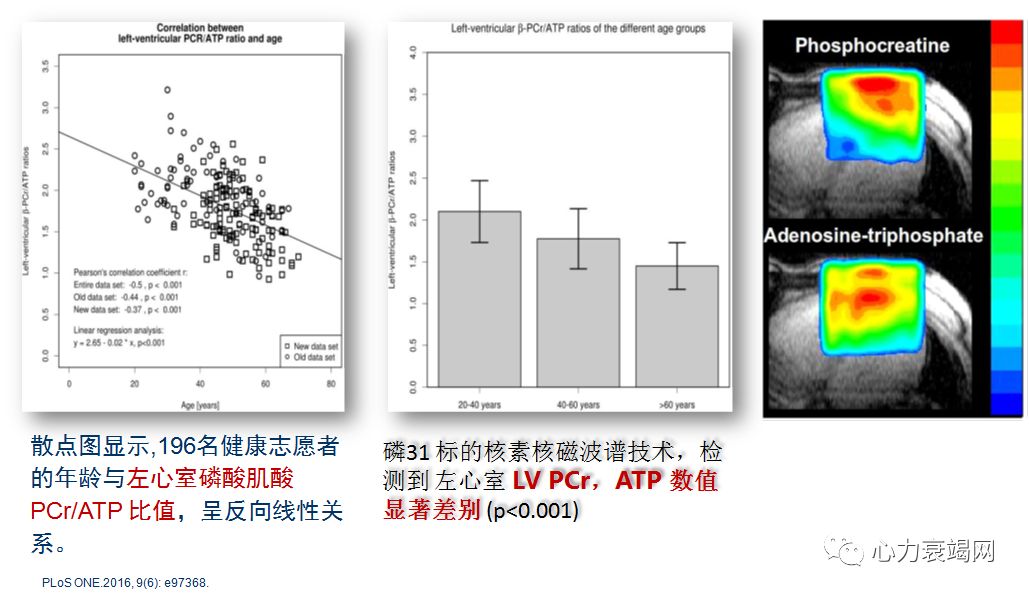
随年龄增加,线粒体功能丢失和损害,氧化磷酸化效率显著降低,产能效率下降,与 PCr减少有关;老年心血管病患者,补充 PCr,可能受益更大;
先前研究,老人PCr和ATP 浓度均降低,PCr和 ATP 的真实浓度及比值,随年龄升高而下降;
一项健康人研究,也证实不仅 PCr和ATP 浓度,而且左心室 PCr/ATP 比值,也呈随龄性下降;
受CK活性影响,CK 活性随年龄升高而降低,导致持续性的细胞内 PCr水平下降和 PCr/ATP 比失调;
1,Alexander KP,et al.Circulation.2007;115(19):2549-2569.
2,PLoSONE. 2016, 9(6): e97368
应用磷酸肌酸
-缺血性心脏病多重获益


作用:补充到心脏中的肌酸,主要以 PCr、Cr形式,改善能量代谢,发挥最大生理性能量贮备和运输作用
❈ PCr,一种内源性物质,是哺乳动物体内主要的高能磷酸化合物,存在于心肌及骨骼肌中
PCr:1 个 PCr分子,即1 mol 浓度含量 (211, 255 g),释放 52 千焦 = 12 千卡能量
ATP:1 个 ATP 分子,即1 mol 浓度含量 (507 g),释放 30 千焦 = 7.3 千卡能量;
ADP:3800 卡/moln
❈ PCr,是心脏内可被迅速动用的能源储备
在心肌细胞内,ATP 浓度是靠 PCr的消耗来维持
当心肌缺血时,早期ATP 减少,发生在大量 PCr减少之后,即先消耗 PCr来维持 ATP浓度
10gPCr = 39 mmol = 0.039 mol = 2.0 千焦
InteractiveCardioVascular and Thoracic Surgery 23 (2016)637–647; Amino Acids (2016) 48:1955–1967
补充到心脏中的肌酸,主要以 PCr、Cr 形式,改善能量代谢,发挥最大的、生理性的能量贮备作用
PCr在心脏也具有多效性,如 PCr直接结合红细胞膜,对抗机械刺激和氧化应激,稳定细胞膜1
PCr/Cr 不仅稳定心肌细胞膜2,还在肝细胞中过表达线粒体CK ,后者降低氧化应激,维持线粒体通透性转运孔 (mPTP) 的关闭3
补充PCr/Cr,降低小鼠心脏中的 mPTP孔道开放4;还降低一些心血管危险因素,例如高半胱氨酸、脂质过氧化等5
1Tokarska-Schlattneret al. 2012;
2 Zucchi et al. 1989;
3 Dolder et al. 2003;
4 Lygate et al. 2012;
5 Deminice et al. 2009
转基因小鼠---缺乏GAMT 酶,不能合成肌酸,引起 PCr/Cr 缺乏;降低了心肌细胞收缩贮备;增加了缺血损伤、再灌注损伤的易感性;
PCr可以保护缺氧应急的心肌,可以显著改善安静状态下,反映心收缩脏功能的多项参数1
GAMT 酶缺乏的动物心肌细胞,补充 PCr可以保护线粒体结构和细胞内亚细胞器的生物膜–肌浆网、肌纤维膜等2
1 Hove et al. 2005
2 Branovets et al. 2013
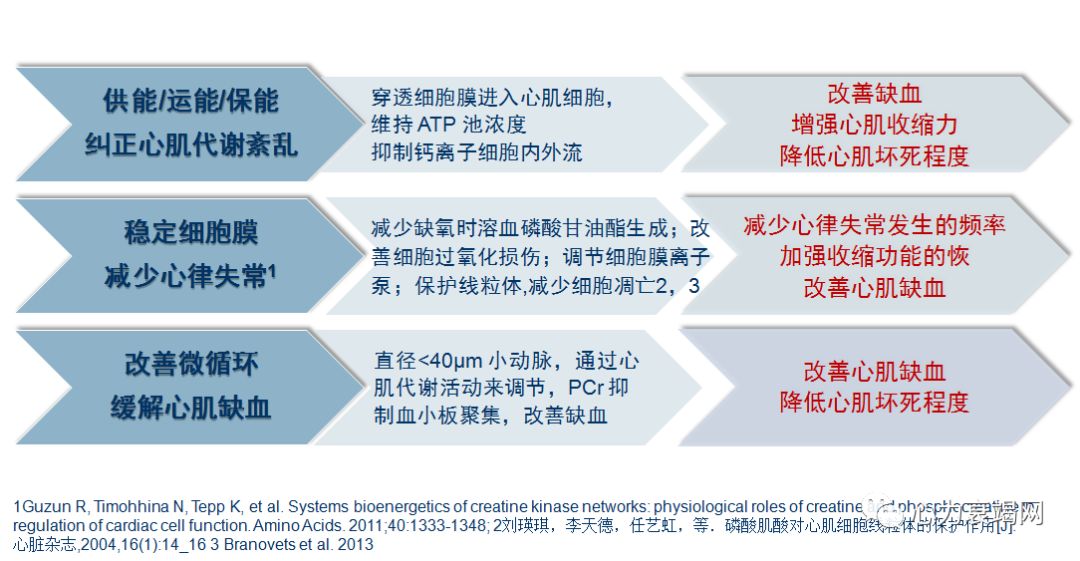
抑制血小板聚集 有效改善缺血部位血供
PCr能与致使血小板凝聚的ADP,共同作为血液中肌酸激酶的底物,参与酶反应,使血小板从凝聚状态变成松散状态,使心肌缺血带的微循环得到改善
直径<40μm 的小动脉,通过心肌代谢活动来调节(非内皮依赖性),代谢增加引起小动脉的舒张,从而导致40-100μm的小动脉内压力下降及肌源性扩张,而后者又引起上游血流增加从而引起内皮依赖性的血管扩张
从临床角度而言,心衰及心肌缺血时的心肌保护极为重要,可改善患者短期及长期预后。
生化机制的实验性及临床研究表明,心衰、心肌缺血期间,心肌细胞高能磷酸盐减少:PCr/ATP。高能磷酸盐的减少程度,与心肌结构及功能改变的严重程度相关联。
Ettore Strumia · Francesco Pelliccia · Giuseppe D’Ambrosio,Adv Ther (2012)29(2):99-123. DOI10.1007/s12325-011-0091-4
PCr可延迟不可逆的肌膜损伤、维持 ATP 池及加速心肌功能恢复,并具有抗心律失常效应。
多项对照研究表明,通过将磷酸肌酸加至心脏停搏液中,可发挥心肌保护作用,保护心脏减轻术中损伤;临床研究结果也呈现一致性。
磷酸肌酸可降低术后心律失常的发生、减少电击复跳的频率及正性肌力药物的需求。
因此,保持细胞内高能磷酸化合物的水平,是纠正心肌损伤的基本原则
EttoreStrumia· Francesco Pelliccia · Giuseppe D’Ambrosio,AdvTher (2012) 29(2):99-123. DOI10.1007/s12325-011-0091-4

总 结
磷酸肌酸应用于AHF、CHF 、ACS、sCAD及PCI、其他手术的围手术期,可改善能量代谢,具备优势:
1、PCr无耗氧直接供能, 快速起效争取时间,降低心肌坏死程度;较其他心肌代谢药物具有先天优势
2、多重机制,多重获益,改善心脏结局:通过增加能量底物来增强肌心肌收缩力、改善心肌缺血、纠正心律失常
3、较少有禁忌症与不良反应,是多靶点治疗中“当然之选”
4、对远期预后“硬终点”的影响,还需深入官观察和探讨;
骆雷鸣教授
中国人民解放军总医院
心内科副主任、博士生导师。近5年来,获得军队医疗成果1等奖、北京科技进步2等奖各一项。承担国家重点基础研究发展计划(973计划)子课题、军队“十一五” 面上课题、军队“十二五”面上课题。近5年来,出版学术专著3部,以第一或通讯作者发表学术论文70余篇, SCI 论著近15篇。2013年被评为解放军总医院“百位名医”培养对象。目前在多家国家级学会任职,包括中华预防医学会循证预防医学委员会委员、中国医师协会心力衰竭专业委员会委员、中国老年学学会心脑血管专业委员会委员、中国药理学会药源性疾病专业委员常务委员、欧洲心脏病学会心衰学会会员、欧洲心脏病学会心脏急诊学会会员。担任中华高血压杂志、中国循证心血管医学杂志、中华临床医师杂志、中华老年医学杂志、中华多器官功能杂志、实用老年医学杂志、中国全科医学杂志、药物不良反应杂志、中国老年心血管病杂志(英文版)、心血管外科杂志的编委或审稿人。从事心血管病专业工作30多年。擅长:冠心病及其他动脉粥样硬化性心血管病的综合治疗;高血压及器官损害的防护与血管动脉硬化/结构功能异常诊治;心力衰竭及心肾联合损害;以及房颤及血栓防治等心血管病的预防及治疗。