


在2017中国国际心力衰竭大会(CIHFC)暨中国医师协会心力衰竭专业委员会年会上,来自西京医院的陈迈教授为我们带来了“ACS合并急性心力衰竭的诊治处理”的精彩报告。

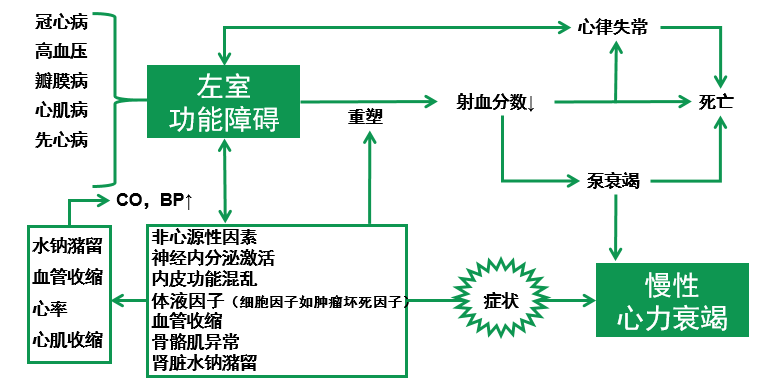
心力衰竭发病机制:进行性,恶性循环
[1]
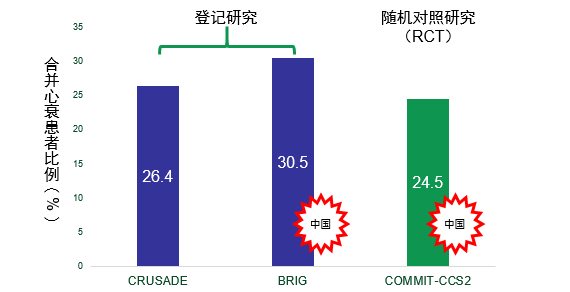
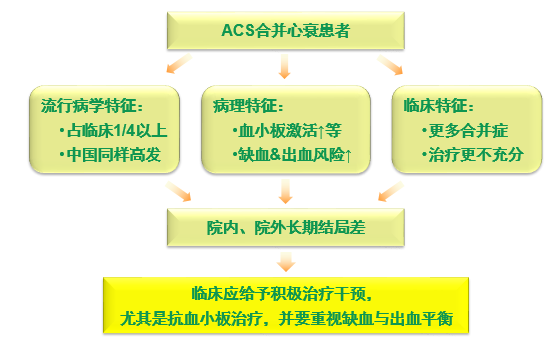
ACS合并心力衰竭患者数量众多,死亡率更高

临床上ACS患者超过1/4合并心衰
[2]
登记研究1,2和RCT3结果均显示,ACS合并心衰患者临床所占比例高达1/4以上,在中国人群中同样高发
全球急性冠状动脉事件注册登记(The Global Registry of Acute Coronary Events,GRACE)表明ACS合并急性心力衰竭患者在院内及发病6月内的生存率明显较无急性心力衰竭ACS患者降低
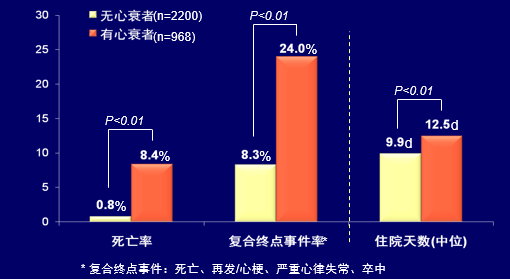
心衰增加ACS患者院内不良结局
在BRIG研究中,与无心衰者相比,ACS合并心衰者院内死亡及复合终点事件显著增高,住院时间延长明显
[3]
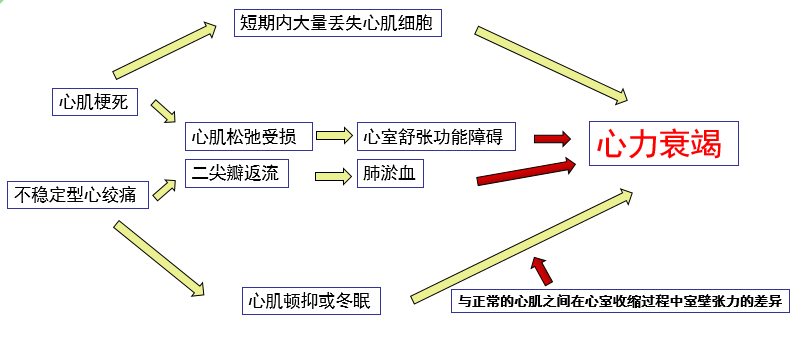
ACS合并心力衰竭的原因
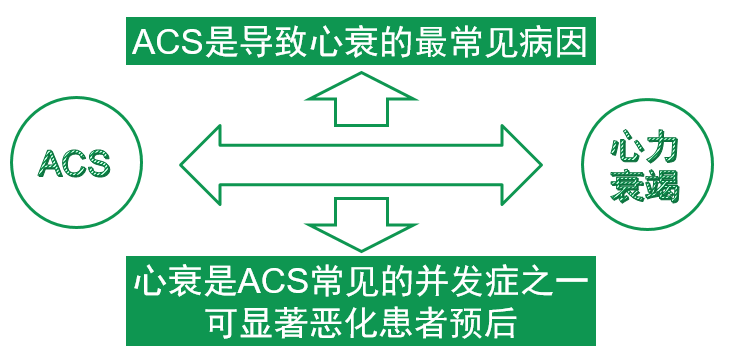
ACS与心衰互为因果,临床密不可分
[4]
心肌梗死是心力衰竭事件链的关键环节
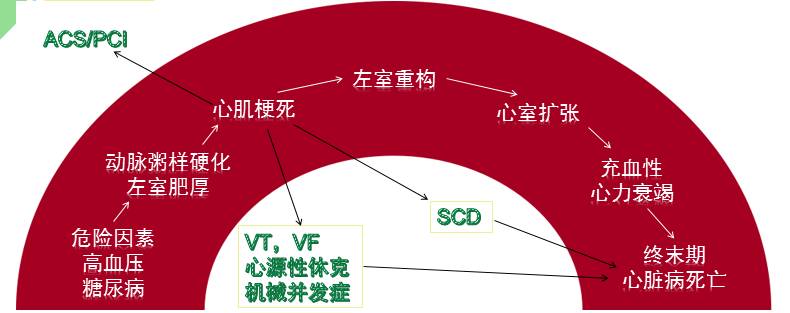
心脏疾病是一系列疾病沿时间发展而成的统一体。它以危险因素为开端,中间经过诸如动脉粥样硬化、心肌梗死、心室重构等独立的危险事件,这些事件或者引发猝死或者促进心力衰竭
急性心力衰竭分类方法
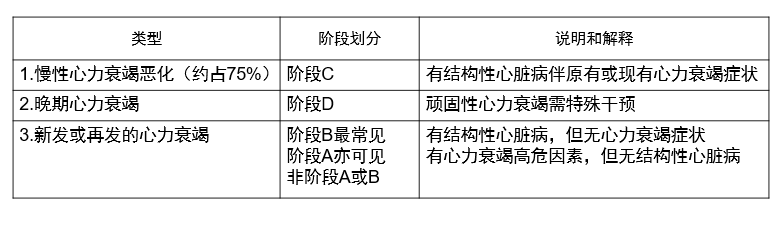
急性心力衰竭的严重程度分级
1. Killip分级
此法适用于急性心肌梗死所致的急性心力衰竭。

2. Forrester分级
根据血流动力学指标如肺毛细血管楔嵌压(PCWP)和心脏指数(CI)进行分级,适合CCU或ICU等应用。
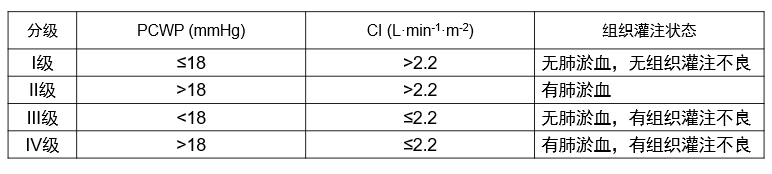
3. AHF血流动力学分型

4. 中国指南推荐的分级法(床边分级)

此处的冷暖指皮肤触诊的感觉。I级为正常,或尚未见明显的左心衰竭;II级为单纯性左心衰竭;III级为肺水肿(皮肤寒冷肺部大量湿啰音),或有急性右心衰竭(皮肤寒冷,肺部无啰音);IV级为重度急性左心衰竭,不仅伴外周循环障碍,并有持续性低血压或心源性休克,还可能伴重要脏器灌注不足,由于代偿性交感神经系统极度冗进,血管收缩、皮肤厥冷、大汗淋漓。
辅助检查
◆胸片:肺静脉淤血、胸腔积液、肺间质或肺泡淤血,心脏扩大是AHF最特异性的表现
◆心电图:可以有助于识别基础心脏病或诱发因素(快速AF、心肌缺血)
◆UCG:血流动力学不稳定患者(心源性休克)和可疑心脏结构或功能异常(机械性并发症、急性瓣膜关闭不全、主动脉夹层);
心肌坏死标志物:
◆CK-MB:早期AMI极好的生物标志,特异性高于肌红蛋白(MG),以 CK- MB1≥1.0u/l,CK-MB2/ CK-MB1比值>1.5为诊断标准,使其敏感性又有所提高
◆肌红蛋白(myoglobin,MG):特异性不高,但能很快释放(1-2h)主要用于除外MI
◆cTnT和cTnI:心肌特异性,对再发MI的诊断尤其有帮助,还可以诊断微小心梗,cTnT的特异性比cTnI略低,因在肌病、肾衰时也可阳性,而cTnI一般为阴性。
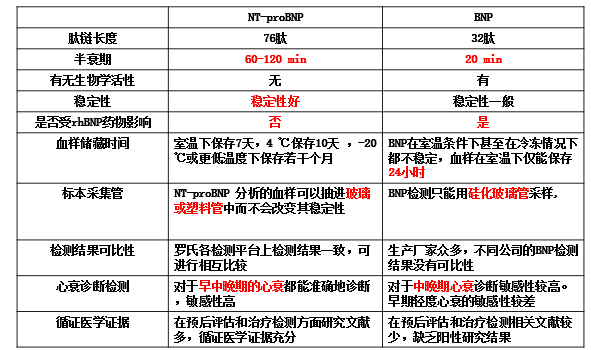
B型利钠肽:BNP和NT-ProBNP
◆BNP基因位于1号染色体上,并与ANP基因相邻 (长约8 kb)1
◆BNP心房细胞的组织表达较心室细胞丰富。但由于心室体积远大于心房,70-88%的BNP来源于心室细胞
◆除心肌细胞外,人体的大脑、肺、肾脏、大动脉及肾上腺还有低浓度的BNP释放
NT-proBNP与BNP的区别
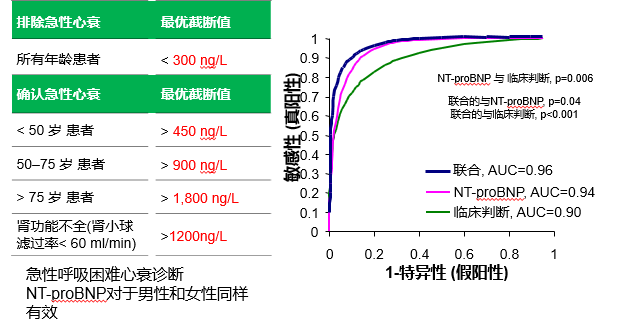
NT-proBNP 协助临床诊断(2014中国心衰指南 I类推荐,A级证据)
NT-proBNP+临床判断,提升诊断效率;
[5]
其他生物学标志物
◆ST2(白细胞介素受体家族成员)
◆Galectin-3(半乳凝素3)
◆中段心房利钠肽前体(MR-proANP)
◆MMP(基质金属蛋白酶 metalloproteinases)
◆微小RNA(miRNA):miR423-5p、miR320a、miR22和miR92b
◆T细胞
ACS合并心衰患者临床结局不佳,治疗干预应更加积极
ACS合并急性左心衰的治疗
临床评估和处理流程
1.临床评估:对患者应根据上述检查方法以及病情变化作出临床评估,评估应多次和动态进行,以调整治疗方案,且应强调个体化治疗。
2.治疗目标:改善急性心衰症状,稳定血液动力学状态,维护重要脏器功能,避免急性心衰复发,改善远期预后。
急性左心衰的处理流程
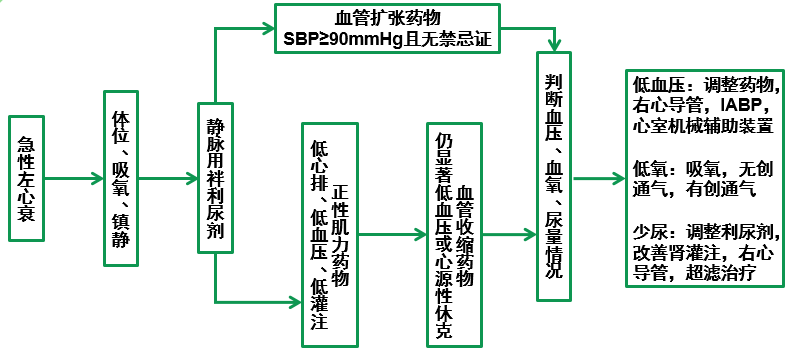
一般处理
1.体位:静息时明显呼吸困难者应半卧位或端坐位,双腿下垂以减少回心血量,降低心脏前负荷。
2.吸氧:适用于低氧血症和呼吸困难明显,尤其指端血氧饱和度<90%的患者。无低氧血症的患者不应常规应用,这可能导致血管收缩和心输出量下降。如需吸氧,应尽早采用,使患者SaO2≥95 %(伴COPD者SaO2> 90% ) 。可采用不同方式:
①鼻导管吸氧:低氧流量(1-2 L/min)开始,根据动脉血气分析结果调整氧流量。
②面罩吸氧:适用于伴呼吸性碱中毒患者。必要时还可采用无创性或气管插管呼吸机辅助通气治疗。
再灌注治疗
目前对STEMI再灌注开始时间理念从D-N和D-B更新为FMC-N和FMC-B
从首次医疗接触开始至溶栓 (FMC-N)或PCI (FMC-B)
溶栓 PCI
STEMI救治:时间就是心肌,时间就是生命
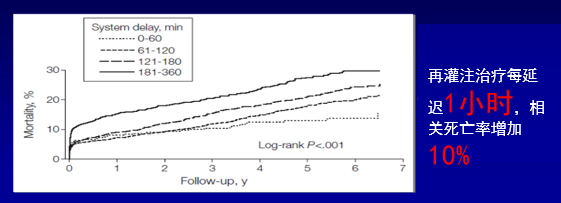
无论是溶栓还是PCI治疗,都应早期再灌注治疗以缩短心肌总缺血时间如不能在120分钟内完成PCI,就应该在30分钟内进行溶栓治疗!
溶栓的流程
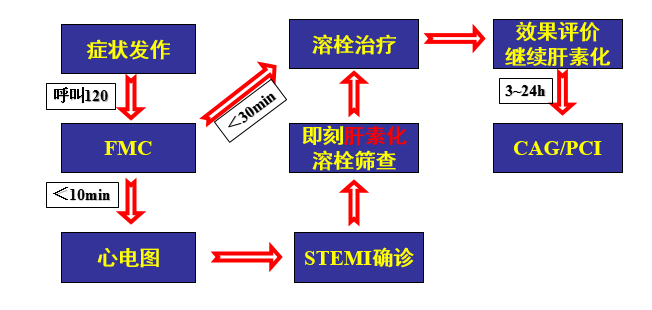
STEMI:
合并急性肺水肿甚至心原性休克患者,血液动力学不稳定患者,SHOCK试验的资料表明,直接PCI与初始内科治疗组比较,可明显降低6个月病死率(50.3% vs 63.1%,P=0.027)。
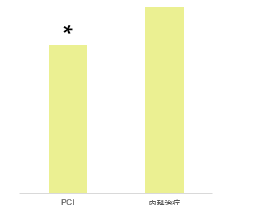
非ST段抬高的ACS:
◆FRISC II(Fraguim and fast Revascularisation during Instability in Coronary artery disease)研究第一个证实非ST段抬高的ACS患者在给与低分子肝素以及阿斯匹林和抗心绞痛药物治疗的情况下,早期侵入性治疗较保守治疗明显降低终点事件(死亡和MI)发生率。
◆TACTICS-TIMI 18(Treat Angina with Aggrastat and determine Cost of Therapy with an Invasive or Conservative Strategy Thrombolysis In Myocardial Infarction-study 18)研究结果显示在给与血小板糖蛋白GPIIb/IIIa受体拮抗剂tirofiban 的前提下,早期侵入性治疗策略优于保守治疗策略。
◆上述两个研究均表明高危患者获益更大
药物治疗
1.基础治疗:吗啡、西地兰
2.利尿剂:呋塞米、托伐普坦
3.血管扩张药物
4.正性肌力药物
5.血管收缩药物
6.抗凝治疗
7.改善预后的药物
药物治疗需要关注的问题
【1. 限水限钠】
明显液体滞留者应严格限制摄入液体量少于2000ml。维持出入量负平衡约500~1500ml/d,此时应防止低血容量、电解质紊乱(低血钾和低血钠等)。数天后水肿明显消退可减少水负平衡量,转为出入量大体平衡。容量负荷过重者,限制钠摄入<2g/d。无需常规和严格限钠,正常饮食可改善预后,限钠对肾功能和神经体液机制有不利作用。
【2. 利尿剂】
容量负荷过重的AHF静脉应用袢利尿剂
新发AHF者或没有接受口服利尿剂治疗的患者,呋塞米起始40mg
可以负荷剂量或持续静脉用药,剂量和时间根据患者症状调整
顽固性水肿或症状缓解不明显者,袢利尿剂联合噻嗪类或螺内酯
在袢利尿剂基础上,可考虑用小剂量多巴胺输入,以改善利尿剂效果和更好的保护肾功能及肾血流。
托伐普坦推荐用于充血性心衰、常规利尿剂治疗效果不佳、有低钠血症或有肾功能损害倾向患者
【3. 血管扩张药物】
可应用于急性心力衰竭早期阶段。收缩压水平是评估此类药是否适宜的重要指标。收缩压>110mmHg通常可安全地使用;在90~110mmHg之间,应慎用;收缩压<90mmHg,则禁忌使用,因可能增加死亡率。血管扩张剂应用过程中要密切监测血压,根据血压调整合适的维持剂量。不主张使用CCB类药物。
主要有硝酸酯类、硝普钠、乌拉地尔、酚妥拉明、压宁定等,已沿用逾数十年。新型的药物有萘西立肽(重组人BNP)、重组人松弛素-2 ( serelaxin)等
【4. 正性肌力药物】
适用于低心排血量综合征,如伴症状性低血压或CO降低伴循环淤血患者,可缓解组织低灌注所致的症状,保证重要脏器的血液供应。血压较低和对血管扩张药物及利尿剂不耐受或反应不佳的患者尤其有效。(C、L型AHF)
常用的有:洋地黄类可用于房颤患者控制心室率,改善症状,一般应用毛花苷C(西地兰)0.2~0.4mg缓慢静脉注射。2~4h后可以再用0.2mg,伴快速心室率的房颤患者可酌情增加剂量。多巴胺、多巴酚丁胺、磷酸二酯酶抑制剂(主要为米力农)等应用十分普遍。新型的有左西孟旦,一种钙增敏剂,通过结合于心肌细胞上的TnC促进心肌收缩,还通过介导ATP敏感的钾通道而发挥血管舒张作用和轻度抑制磷酸二酯酶的效应。其正性肌力作用独立于β肾上腺素能刺激,可用于正接受β受体阻滞剂治疗的患者。
【5. 血管收缩药物】
对外周动脉有显著缩血管作用的药物如去甲肾上腺素、肾上腺素等,多用于正性肌力药物应用后仍伴显著低血压或心源性休克患者。这些药物可以使心输出量重新分配至重要脏器,收缩外周血管并提高血压,但以增加左室后负荷为代价。这些药物具有正性肌力活性,也有类似于正性肌力药的不良反应。
【6. β受体阻断药】
慢性心力衰竭发生急性失代偿时,原有的指南均建议减量或停止使用β受体阻断药,待急性心力衰竭得到控制,症状改善后再加用。但是,新近的指南建议失代偿如并非因为β受体阻断药所致,则不宜减量或停用,这对于急性期治疗并无好处,反而使尔后该药的加用和增加剂量造成困难。OPTIMIZE-HF注册研究亦表明,β受体阻断药的继续应用对患者出院后生存有益,可降低风险,降低出院后再住院率,停用者风险显著升高。
【7. 他汀类药物】
积极的他汀类药物治疗可以降低LDL-C,显著降低ACS的致死率和致残率以及致死或非致死性心肌梗死、脑卒中等的风险,并降低对PCI于CABG术的需求。目前他汀类药物已成为冠心病二级预防的基础治疗方法。
【8. 抗血小板治疗】
阿司匹林仍是防止冠脉血栓形成药物的基石。长期使用大于75mg/d的剂量时,阿司匹林可抑制血小板COX1进而抑制血栓素的形成,从而达到抑制血小板聚集的作用。
自1998年被FDA批准以来,氯吡格雷已成为ACS最常用的抗血小板药物之一。替格瑞洛虽然是一种新型的口服P2Y12受体抑制剂,与氯吡格雷相比起效更迅速且持久,但失效也快,由于其在患者中的不良反应率较高,因此对于亚洲ACS或PCI患者来说,仍然建议阿司匹林基础上加用氯吡格雷作为抗血小板药物的首选。
【9. ACEI 和 ARB】
该药在急性心衰中的应用仍有诸多争议。急性期、病情尚未稳定的患者不宜应用(IIb类,C级)。AMI后的急性心衰可试用(IIa类,C级),但起始剂量宜小。在急性期病情稳定48 h后逐渐加量(I类,A级),不能耐受ACEI者可应用ARB。
【10. 醛固酮】
◆醛固酮拮抗剂是继ACE-I和 ß受体阻滞剂后第三个能降低心衰患者死亡率的药物
◆醛固酮阻断可在常规治疗的基础上进一步降低死亡率和并发症
非药物治疗
◆由于ACS患者大多数均有发生冠脉内血栓形成的可能,因此其治疗原则要求及早进行冠状动脉血运重建,尽快开通IRA,恢复心肌微循环的血液再灌注。PCI虽然能有效开通IRA,及时恢复心肌的再灌注水平,但同时也有发生远端血管栓塞的风险。
◆机械辅助装置,IABP,左心室辅助装置等应用可能降低心脏负荷,缓解症状并改善预后。
◆ ACS与心衰互为因果,临床密不可分
◆ ACS合并心衰患者存在高发病率、高缺血+出血风险、多合并症,治疗不充分等特点,临床结局差
◆ACS合并心衰患者临床治疗干预应更加积极
[1]《急性心肌衰竭诊断和治疗指南》
[2]1.Roe MT, Chen AY, Riba AL, et al. Am J Cardiol. 2006;97(12):1707-12. 2.Wang N, Zhao D, Liu J, et al. Int J Cardiol, 2011 Mar 29.
3.Chen ZM, Jiang LX,Chen YP, et al. Lancet, 2005;366(9497):1607-21.
[3]3. Wang N, Zhao D, Liu J, et al. Int J Cardiol. 2011 Mar
[4]Steg PG, Dabbous OH,Feldman LJ, et al. Circulation, 2004;109(4):494-9
[5]中华医学会心血管病学分会, et al. 中华心血管病杂志, 2014; 42(2):98-122.
Januzzi, J. et al.Eur Heart J.2006;27(3):330-337.
Januzzi, J.L. et al.Am J Cardiol.2005;95 (8):948-954.