


9大类心血管并发症发生发展的病理生理机制和诊疗方法。
提出心肌损伤和心力衰竭是癌症治疗相关最严重的心血管并发症,直接影响预后。该并发症的发生时间及严重程度差异性较大。在文中列出了不同癌症治疗药物导致心肌功能障碍和心力衰竭的发病率情况(表1)。列举了不同种类化疗药物及放疗导致心肌功能障碍和心力衰竭的相关危险因素(表2,表3)。列举了临床上可以应用的筛查心血管并发症的工具(表4),并详细介绍了各个检查所示心肌功能异常和心力衰竭发生的定义,以及该检查的优点及缺点。
表1 不同癌症治疗药物导致心肌功能障碍和心力衰竭的发病率情况
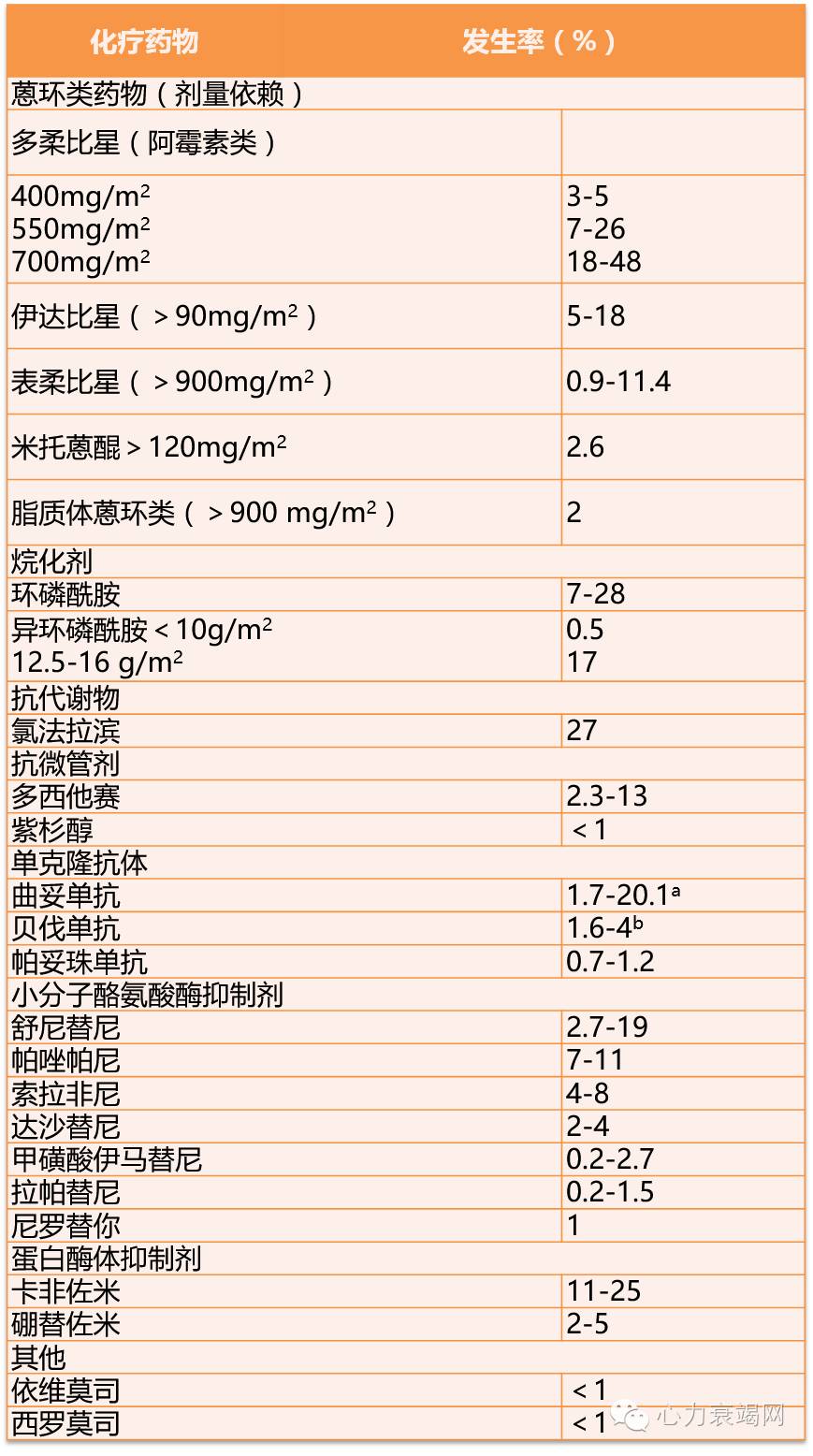
表2 不同种类化疗药物及放疗导致心肌功能障碍和心力衰竭的相关危险因素

表3 不同种类化疗药物及放疗导致心肌功能障碍和心力衰竭的相关危险因素
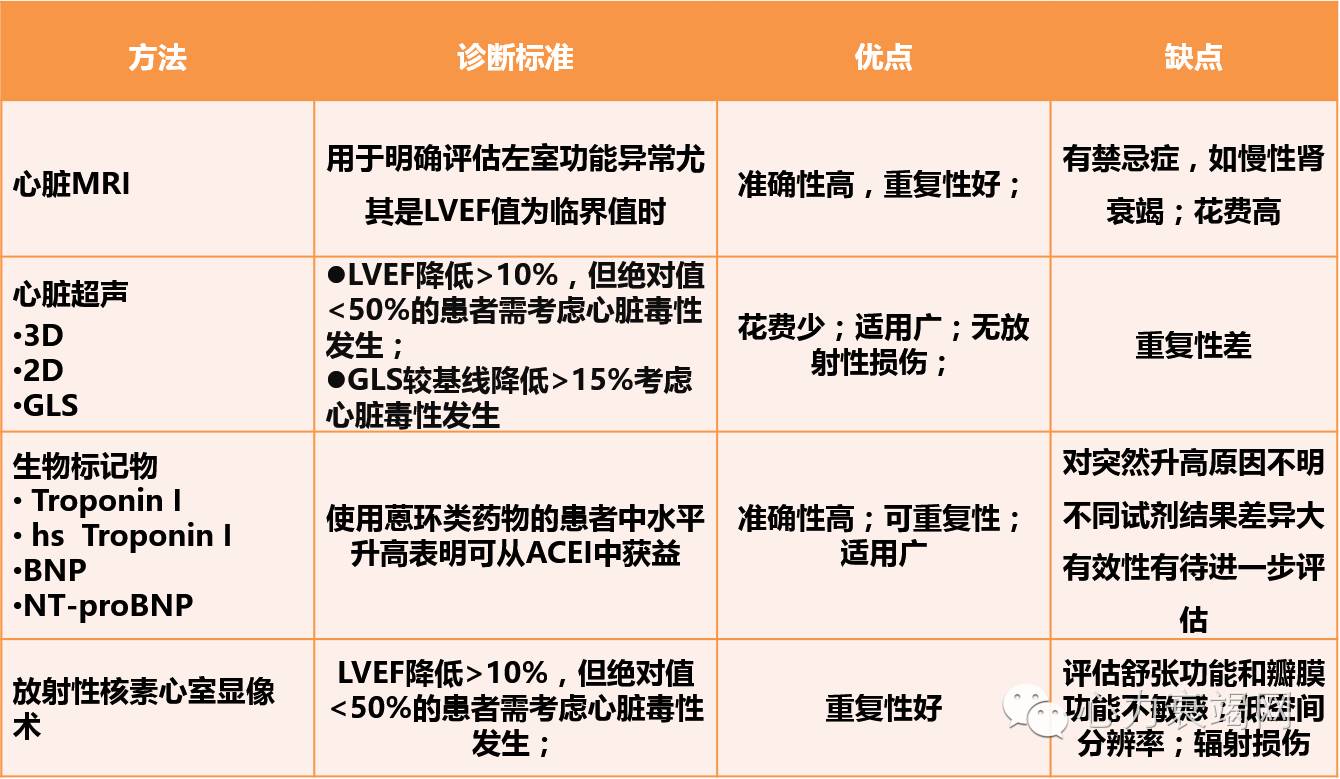
表4 临床上可以应用的筛查心血管并发症的工具
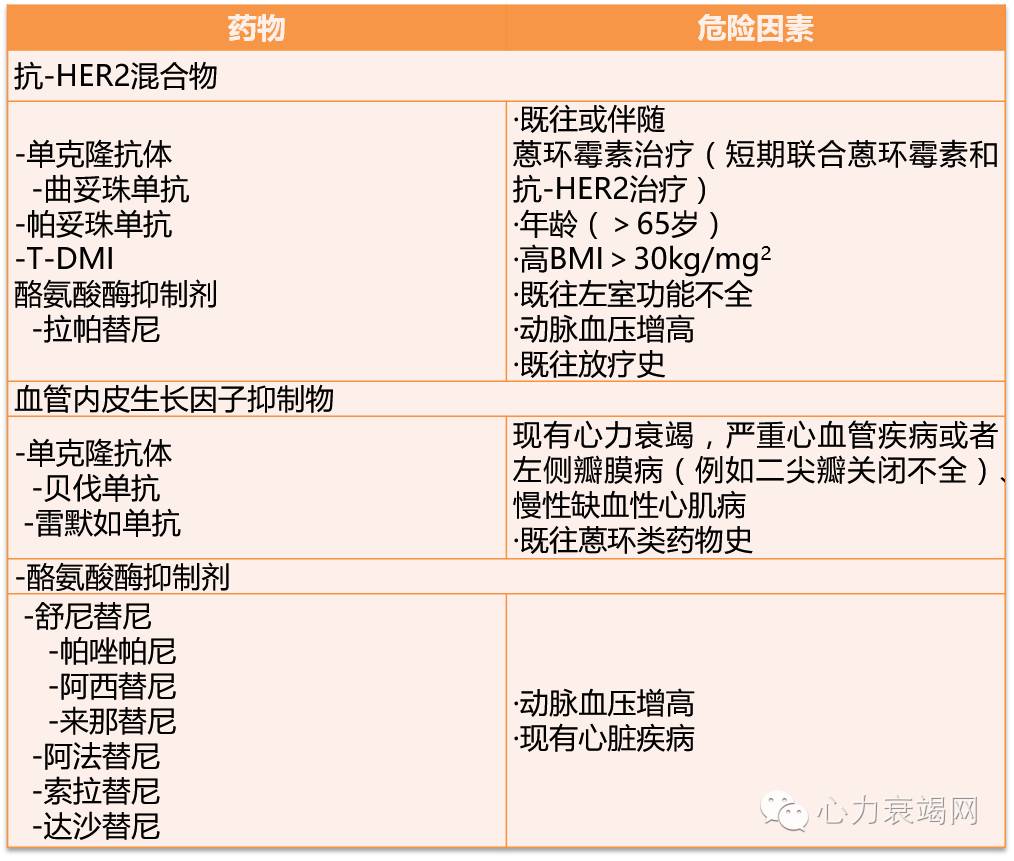
对于使用可导致心肌损伤和心衰的治疗方案的高危癌症患者强调应加强自身危险因素控制。在癌症治疗前、治疗中及治疗后监测LVEF,以便早期发现并发症。该工作组建议将正常LVEF的下限定为50%,针对患者LVEF值给予不同处理方案:(1)LVEF降低>10%,但绝对值>50%的患者,应短期内重复测量并在癌症治疗过程中密切监测LVEF。(2)LVEF降低>10%,但绝对值<50%的患者,应高度警惕,在没有明确禁忌症的情况下需给予ACEI(或ARB)联合β受体阻滞剂治疗,预防病情进展。
明确了癌症治疗相关冠状动脉疾病相关风险因素,如患者病史、年龄、性别、相关化疗药物;在识别隐匿性冠状动脉疾病方面,应在化疗前详细评估病情,必要时行心肌缺血相关检查,有助于更安全的选择化疗方案; 对于应用嘧啶类似物化疗的患者,应密切监测ECG,若发生缺血事件,需终止治疗;癌症治疗后的冠脉痉挛可应用硝酸酯类和(或)钙离子拮抗剂)治疗。但冠脉痉挛后的二次给药应谨慎,需在充分保护及严密监测下进行;对于已知冠脉疾病患者,长期临床随访,必要时行缺血性心脏病相关检查,有助于发现放化疗后远期冠脉相关疾病。
超声心动图是评估癌症治疗相关心脏瓣膜疾病的重要方法,三维超声心动图有助于二尖瓣结合部病变;与化疗相比,放疗更易损伤心脏瓣膜,因此对纵隔放疗的患者应在基线和放疗后反复行心脏超声检查;心脏MRI和CT均可用于评估瓣膜病的严重程度,但CT对升主动脉弥漫性钙化效果更佳。
癌症治疗可导致多种心律失常,如Bradycardia、窦速、房室传导阻滞、房颤、室上速、室颤/室速、猝死;所有癌症患者治疗前均行12导联ECG,并记录QTc;对于有QTc间期延长病史、使用致QT间期延长药物、 Bradycardia、甲状腺功能异常及电解质紊乱患者,在癌症治疗期间应密切随访12导联ECG;癌症治疗期间如QTc>500ms、 QTc延长超过60ms或节律异常者,应终止或调整治疗方案;对药物致QT间期延长患者,需避免引起尖端扭转的情况,如低血钾、心动过缓;需使用致QT间期延长的化疗药物时,其他致QT间期延长药物应给予最小有效剂量。
治疗前、治疗中及治疗后需密切监测血压,并根据现行临床指南个体化制定降压方案;常规降压药物对癌症患者的高血压治疗有效。尽早、严格控制血压可预防心血管并发症;推荐ACEI(或ARB)、BB及二氢吡啶类钙离子拮抗剂为降压首选;慎用非二氢吡啶类钙离子拮抗剂;对血压未达标者,可降低化疗剂量、暂停VEGF抑制剂或加强降压治疗;血压达标后,VEGF抑制剂可调整至最佳剂量。
癌症患者不推荐常规行血栓性疾病筛查,无症状性血栓性疾病的治疗同症状性血栓性疾病;对需接受及已接受抗凝治疗的VTE患者,应依据预期寿命及出血风险,定期间断评估抗凝风险及获益;血流动力学稳定的VTE患者,推荐低分子肝素抗凝治疗3-6月,序贯VKA。因肿瘤是VTE复发的高危因素,抗凝治疗需持续至肿瘤治愈;抗凝治疗失败的下肢VTE患者,可考虑置入下腔静脉滤器;动脉栓塞性疾病的处理方案研究较少,需心脏科、肿瘤科和血管外科医生共同协商制定。
开始癌症治疗前评估外周血管病(PAD)发生风险,评估项目包括危险因素、体格检查及踝-肱指数;PAD1-2期(无症状或仅间歇性跛行)患者,需积极控制危险因素,密切随访;对有症状的PAD患者,推荐抗血小板治疗;对病情重的PAD患者,应多学科(血液科、血管外科、肿瘤科及心内科)会诊,共同决定下一步治疗方案。
癌症治疗相关肺动脉高压首先需完善基线评估内容,如肺动脉高压相关危险因素;评估NYHA/WHO功能分级;监测NT-proBNP;对可能肺高压患者行心脏超声评估;病人的管理需从2个方面出发,(1)无症状性患者管理方案:每3个月评估NYHA/WHO功能分级;每3个月行心脏超声评估肺动脉压力;必要时行右心导管检查;评估可引起肺高压的其他病因;症状性患者管理方案;评估NYHA/WHO功能分级;行心脏超声评估肺动脉压力;必要时行右心导管检查;评估可引起肺高压的其他病因;6分钟步行试验,测血NT-proBNP 。
(1)心包疾病
急性心包炎主要与蒽环类、环磷酰胺、阿糖胞苷及博莱霉素等药物相关,放疗所致急性心包炎少见;经胸心脏超声是评估可疑心包病变的有效工具,CT对钙化病变评估效果更佳;心包积液的治疗包括对于轻症患者可给予非甾体抗炎药、秋水仙碱;而大量心包积液可行心包穿刺术;当出现血流动力学不稳定时可行心包开窗术。
迟发性心包炎多发生在放疗后0.5-15年,多数自愈;接受大剂量放射治疗后患者约20%发生缩窄性心包炎;
(2)胸腔积液
癌症、HF、感染等其他原因均可导致胸腔积液;治疗诱因,当积液量较大时可行胸腔穿刺引流术。
(3)自主神经功能异常
该并发症由放疗所致心脏交感神经损伤引起,可表现为窦速、改变心率变异性等。
预防和降低癌症治疗相关心血管并发症
(1)开始癌症治疗前
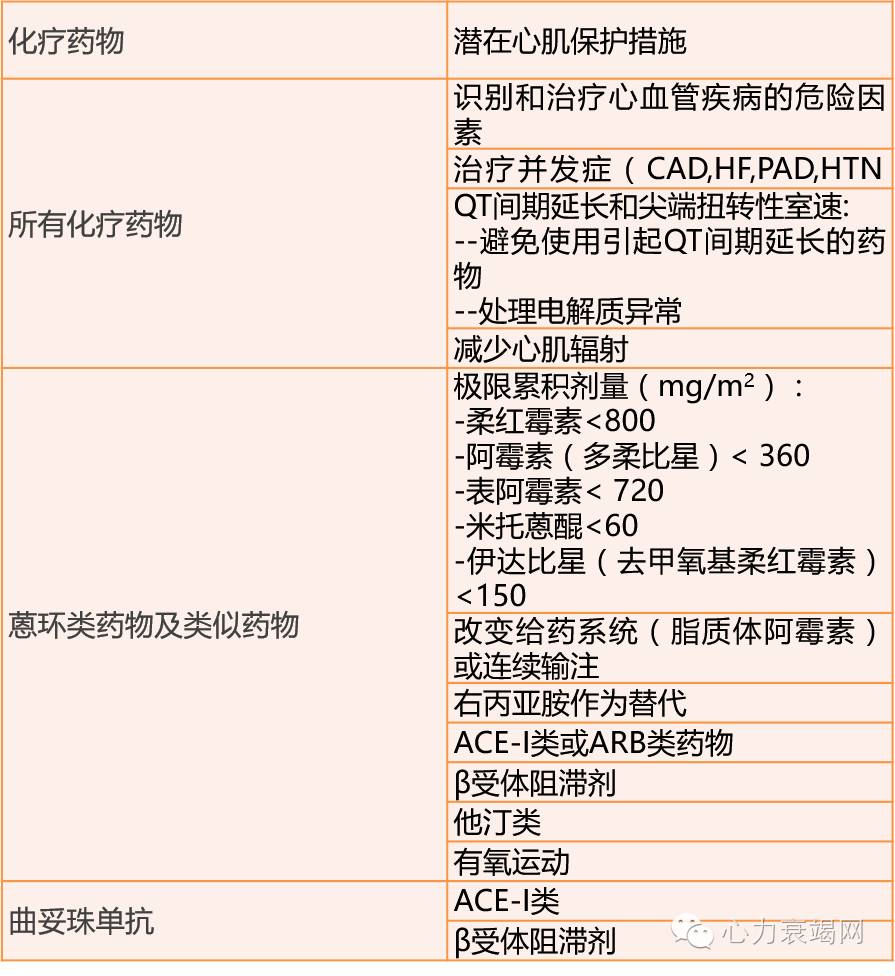
心肌保护作用的时机和选择取决于各种临床因素。如果个体存在有CVD,先前使用过含蒽环类化疗或有控制不良的心血管危险因素,那么基线心脏毒性风险高,必须采取强化控制危险因素从而保护心脏的药物预防方案(表5)。基线心脏毒性风险低、采取蒽环类药物治疗累积剂量高(>250-300 mg/m2阿霉素或等效药物)的癌症患者或许也应考虑使用预防性保护心脏的药物。
表5 临床上可以应用的筛查心血管并发症的工具
一项小的随机研究分析显示,在患有血液系统恶性肿瘤并计划使用高剂量蒽环类药物化疗的成年患者中,随机分为依那普利+卡维地洛组与常规护理组,在第一周期化疗前即开始干预。6个月随访时发现在使用心脏保护药物的患者避免了对照组中LVEF降低的情况。但基线风险低、使用蒽环类药物的患者是否该应用ACEI、ARB、β-受体阻滞剂治疗仍有争议,且没有相关建议。
最近进行的一项蒽环类药物治疗早期乳腺癌的前瞻性、安慰剂对照试验中,使用ARB坎地沙坦与安慰剂或β-受体阻滞剂治疗相比,减弱了LVEF下降趋势,但在GLS或心脏标记物方面没有变化。在这项试验中,美托洛尔并没有阻止因化疗相关引起的LVEF降低。同样,所以无论是ACEI类培哚普利还是β-受体阻滞剂比索洛尔均没有任何改善使用赫赛汀治疗的早期乳腺癌患者的心脏重塑作用。但是大部分患者均没有预先使用蒽环类药物治疗,因此发生癌症治疗相关心脏副作用风险较低。
基线存在有临床心衰症状,或显著左室功能不全的癌症患者需要进行专门的心脏检查,最好是在专业的肿瘤-心脏病诊所中,在那里肿瘤学团队可通过对风险与获益的比较从而选择化疗方案。包括选择无心脏毒性的化疗方案、较低心脏毒性的蒽环类药物制剂(如阿霉素脂质体)、减少化疗计划剂量和/或添加额外的心脏保护药物(如ACEI,β受体阻滞剂、醛固酮拮抗剂或右丙亚胺)(Table 5)。
右丙亚胺是细胞内的铁螯合剂,可防止由于阿霉素所致的左室功能降低,因此被认为可在特定的情况下作为多柔比星的替代药物。Cochrane一项荟萃分析显示,在应用蒽环类药物治疗的成人癌症患者中,右丙亚胺可显著降低心衰风险,并且没有证据证明右丙亚胺组和对照组中在癌症治疗有效率、生存率或继发恶性肿瘤方面有差异。其他一些荟萃分析显示在使用右丙亚胺治疗的儿童肿瘤患者中,在继发肿瘤方面没有差异。目前欧洲对右丙亚胺的应用仅限于对已应用阿霉素累积剂量>300 mg/m或表阿霉素累积剂量>540 mg/m2,并且能从持续的蒽环类药物治疗中获益的癌症晚期或转移性乳腺癌患者。
(2)当发现患者Troponin升高时
对在接受大剂量蒽环类药物治疗中肌钙蛋白升高的患者应考虑予以心脏保护。一项临床试验入组了114名接受大剂量化疗药物治疗并在早期(每个化疗周期的前72小时内)引起肌钙蛋白水平升高的患者,随机予依那普利与安慰剂治疗,随访12个月后研究结果显示依那普利组可显著降低心脏事件的发生率,包括心衰和无症状左室功能不全发生率。
(3)当在癌症治疗中或治疗后出现无症状性LVEF减低时
LVEF降低符合心脏毒性的定义,即可视为B期心衰患者(即患者有心脏结构性改变,但目前或既往没有心衰相关症状),尤其是同时伴有脑钠肽的升高。根据LVEF值下降的幅度,需启用一个或更多以临床指南为指导的心衰治疗措施。
一项观察性研究评估了依那普利的和卡维地洛对以大剂量蒽环类药物为基础化疗方案并引起LVEF≤45%患者的作用。尽管没有对照组,应用依那普利和卡维地洛治疗后42%患者LVEF得以恢复。重要的是,化疗结束后6个月内通过心脏特异性治疗增加了左室功能恢复可能性。一项长期研究显示,心衰优化治疗似乎与化疗后左室功能不全的改善有关。
(4)癌症病人在治疗中和随访过程中出现心力衰竭时
在化疗中或化疗后出现有临床心衰症状的癌症患者应按心衰指南进行指导治疗。当在化疗过程中出现心衰时,最好转诊到肿瘤-心脏病专科,同时应与肿瘤团队保持密切联系,通过其建议以确定癌症治疗中断时机以及持续时间,直至患者病情平稳。既往方案进一步治疗的风险与利益评估将取决于几个临床因素,包括左室功能不全的严重程度,临床心衰状态,癌症治疗的预后以及抗癌治疗的疗效。
如再次应用既往曾引起心脏毒性的药物,强烈推荐持续应用心肌保护药物如ACEI和β受体阻滞剂。其他可能的选择包括应用潜在心脏毒性较小的制剂(如脂质体阿霉素)或其他心脏毒性较小的药物(如右丙亚胺)
(5)非药物治疗在心脏保护中的作用
强烈建议积极的促进健康行为,包括生活方式(健康饮食,戒烟,规律运动,控制体重)。尤其是有氧运动,被认为是一种可防止或治疗因化疗引起的心脏毒性的很有前途的非药物预防策略。经测试当散步、骑自行车,以及相关体育锻炼进行比较密集时所带来的好处更大,但不提倡锻炼到精疲力竭。
接受癌症治疗的患者往往有多种生理和心理不良影响。系统多学科的长期管理方法对癌症患者是必不可少。一项回顾分析纳入56个临床试验,4826名受试者,研究结果表明在经过运动训练计划后,受试者生活质量和身体能力均有提高(表6)。
表6 经过运动训练计划后,受试者生活质量和身体能力均有提高

(1)蒽环类药物
目前存在多种策略可以用来预防因使用蒽环类药物导致左心室功能不全和心力衰竭,同时维持抗肿瘤治疗的疗效,包括:减少化疗药物累积剂量;使用连续输注(48–96 h)降低成人患者血浆峰值;使用类似物(表柔比星,匹克生琼)或脂质体制剂;使用右丙亚胺作为心脏保护。但有证据显示在疗效相同或优于蒽环类药物治疗时,应考虑以上方法,尤其是患者有心血管危险因素或既往曾暴露于蒽环类药物。
紫杉类药物降低阿霉素排泄,导致其血浆水平较高,并促进心肌代谢转化为毒性代谢。紫杉醇联合应用蒽环类药物可增强心脏毒性。在这种情况下,紫杉醇比多西紫杉醇心脏毒性更强。因此,建议化疗时在紫杉醇应用前使用蒽环类,单独输注和/或限制阿霉素最大累积剂量到360mg / m2。如上述所言,对抗肿瘤治疗前心功能正常和低风险的癌症患者,心脏药物(ACEI、ARB和β受体阻滞剂)的应用对蒽环类化疗药物引起的心脏副作用的预防作用仍然是有争议的,需要更多数据。
(2)HER2靶向治疗
蒽环类药物、赫赛汀联合应用可显著增加心衰的发病率,但采用间隔给药的方式可明显降低心脏毒性。在进展到心衰的转移肿瘤患者可观察到12个月时LVEF的恢复与ACEI和β-阻滞剂的治疗有联系,同时赫赛汀进一步给药并不一定引起心衰的进展。此外,在接受赫赛汀和蒽环类药物治疗前LVEF正常的乳腺癌患者,连续使用β-受体阻滞剂可降低心衰的发病率。这一发现是否也适用于赫赛汀治疗前以非蒽环类药物为主的化疗仍然存在争议,没有相关建议。
美国国家癌症研究所建议如果LVEF降低至<45%或基线LVEF在45%到49%之间降低10% ,应中断赫赛汀并加用ACEI;如果LVEF恢复到>49%,赫赛汀可重新开始应用;如果LVEF<50%但>44%,赫赛汀可继续同时加用ACEI。如果在加用ACEI治疗后LVEF仍下降,应转诊心脏病专家,并且最好同时提供肿瘤-心脏病的相关建议。在特定情况下,根据合并症情况可能优先选择β-受体阻滞剂而不是ACEI。目前正在进行以下试验评估坎地沙坦(NCT00459771),赖诺普利–卡维地洛(NCT01009918)和培哚普利–比索洛尔(NCT01016886)联合应用以减少曲妥珠单抗引起的心脏毒性的预防作用。
欧洲肿瘤医学学会指南建议,为预防赫赛汀诱导的心脏毒性应延长以蒽环类为基础化疗方案和应用赫赛汀之间的时间,同时在化疗开始前和随访中应仔细评估患者心功能,对高血压或新发左室功能不全的预防使用ACEI进行控制。
有规律的有氧运动似乎是一种很有前途的策略,可减弱因阿霉素引起的左室功能不全影响,但对赫赛汀引起的心脏毒性作用不明显。
(3)嘧啶类似物
在已存在CAD的癌症患者中予以化疗药物治疗时可能会引起心肌缺血,在应用抗肿瘤药物前,应按遵循ESC临床指南积极控制冠心病危险因素(吸烟、高血压、糖尿病、高脂血症)并进行药物治疗。予以嘧啶类似物治疗的患者经常出现心绞痛,缺血相关心电图异常、心律失常和心肌梗死,甚至在冠脉正常的患者中也可出现。有既往冠心病病史的患者的风险明显增加,硝酸盐和/或钙通道阻滞剂预防性管理可能不会有效。在这类患者中不建议予以嘧啶类似物治疗。如果不能进行替代治疗那么应密切监测病人情况。
(4)VEGF抑制剂
仔细评估基线心血管危险因素,密切进行血压监测,以确保及时和积极进行VEGF治疗的高血压患者的管理。具体治疗见癌症治疗相关高血压章节。
(5)放疗
心脏保留放射治疗技术应降低辐射剂量和心脏体积暴露。这些结果可能通过基于三维治疗计划的现代技术达到,强大的软件系统能够精确地描绘出癌症的轮廓,并引导辐射。尽管采取了相关措施,但接近靶区时,心脏辐射是不可避免的,如左侧乳房乳腺癌和某些情况下的霍奇金淋巴瘤。
癌症长期生存患者的监测机制
以蒽环类化疗药物治疗为主的儿童和成年长期生存者是发生左室功能不全及心力衰竭的高风险人群。发展为心衰的时间间隔较长(>10年)。因此,接受具有心脏毒性的癌症治疗方案,特别是蒽环类药物治疗的无症状患者,可能会并发左室功能不全和心力衰竭。所以,应该定期检测该人群心脏影像学和标志物,如BNP,特别是那些接受了累积高剂量药物和肿瘤治疗期间已经发生左室功能不全的患者。任何可能提示心衰的症状都应该被重视,因为许多疾病会掩盖已经降低的心脏储备功能。不推荐早期停止保护心脏避免心衰的治疗。尽管缺乏相关临床试验数据,仍然推荐继续抗心衰治疗,除非停止治疗后左室收缩功能维持正常的稳定状态,且患者不会进一步接受肿瘤治疗。由于赫赛汀引起的心功能不全通常可以逆转,使用这类药物的患者在左室功能恢复正常后可以停止抗心衰治疗。
评估缺血性和血管性疾病应该推荐用于有纵膈放疗史的患者,即便这类患者无症状也应在放疗后5年开始评估,且至少每5年1次。一项大型研究表明大部分纵膈放疗史的患者存在隐匿的心血管疾病,并推荐检测缺血性心肌病。当患者在同时接受放疗治疗和化疗时,血管损伤部位可能距离放射区域较远。考虑到既往接受过颈部放疗患者有着很高的中风风险,颈动脉超声扫描应该纳入全面的心脑血管风险评估用于发现亚临床动脉粥样硬化。
放疗所致的瓣膜病越来越多见于纵膈放疗后的患者,其诊断的平均中位时间为22年。随访20年发现仅有少部分人其主动脉瓣是完全正常的。儿童时期发生肿瘤的存活着有着很高的三尖瓣关闭不全发生率,其原因有待进一步确定。通常,患者在诊断瓣膜病时已经不再接受肿瘤相关治疗,然而令人吃惊的是,肿瘤诊断或放射治疗史常常没有在患者的病史资料中提及。EACVI/ASE推荐对于有症状的患者应该每年进行一次病史记录和超声检查。而对于无症状的患者,EACVI/ASE推荐放疗史10年后应该每年接受一次经胸主动脉瓣超声检查,连续5年。经食道超声能够提供更多的信息,特别是存在严重瓣膜钙化或纤维化的情况,因为会影响经胸超声图像质量。此外,3D超声或许有助于评价二尖瓣形态学。CMR可能有助于鉴别。
学科发展面临的问题
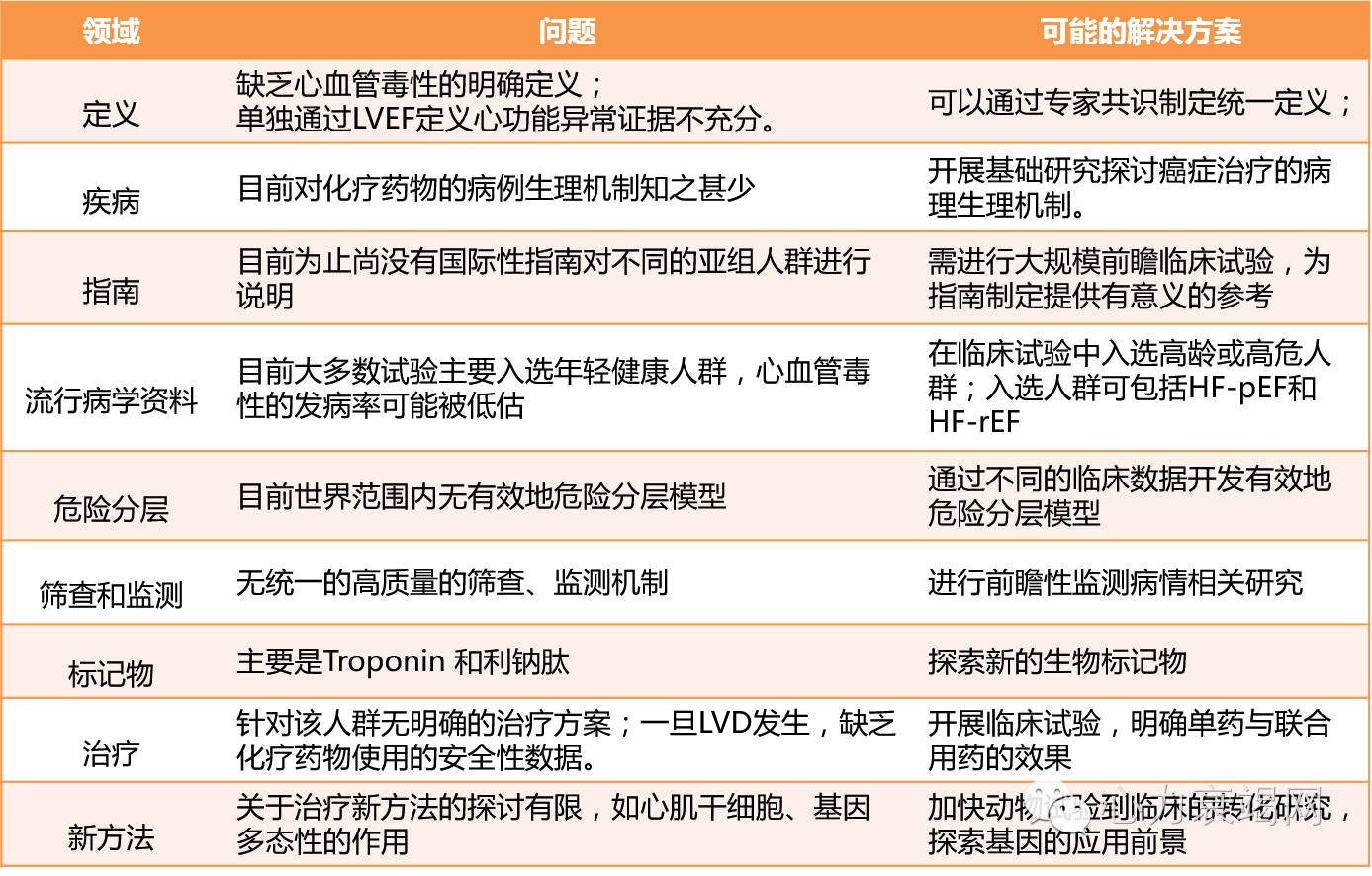
2016年初Professor Butler就癌症治疗相关心血管毒性的流行病学、危险因素、疾病监测及诊疗做了详细的描述.在文章中他提出肿瘤心脏病学作为一门新兴的交叉学科,目前的发展也面临着诸多的问题(表7),如有不解决好,将大大限制其发展,同时他也提出了问题的解决方法。最后指出,肿瘤心脏病学的发展不仅需要肿瘤医生、心脏科医生及基础研究工作者的团结协作,更需要提高社会认知,争取获得更多的社会认可及帮助。
表7 目前的发展也面临着诸多的问题
作者:中国医学科学院阜外医院 张宇辉 安涛