陈良华教授:限制型心肌病发病机制
点击量: 时间:2020-02-27 19:00

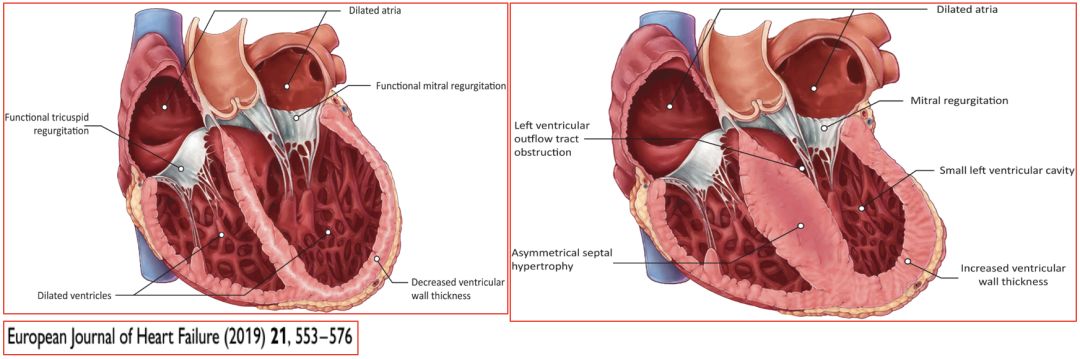
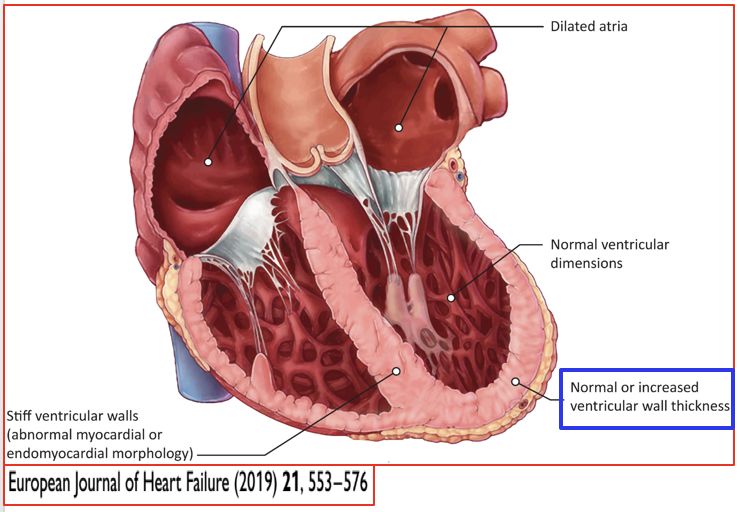
• 因心肌僵硬度增加引起限制性心室充盈障碍(表现为舒张功能不全)的一组异质性疾病
• 单心室或双心室受累;左、右心房扩大,而左、右心室容积及收缩功能通常正常
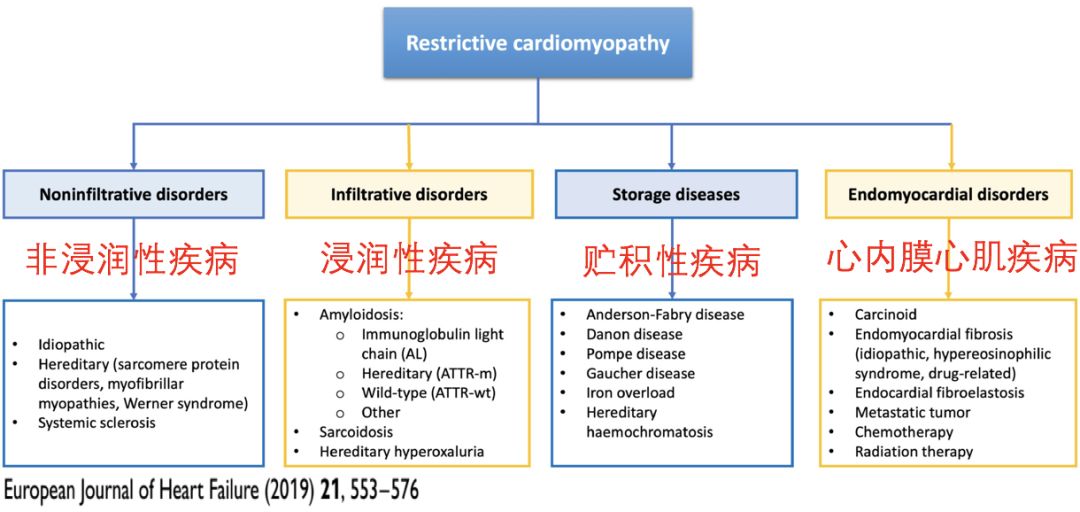
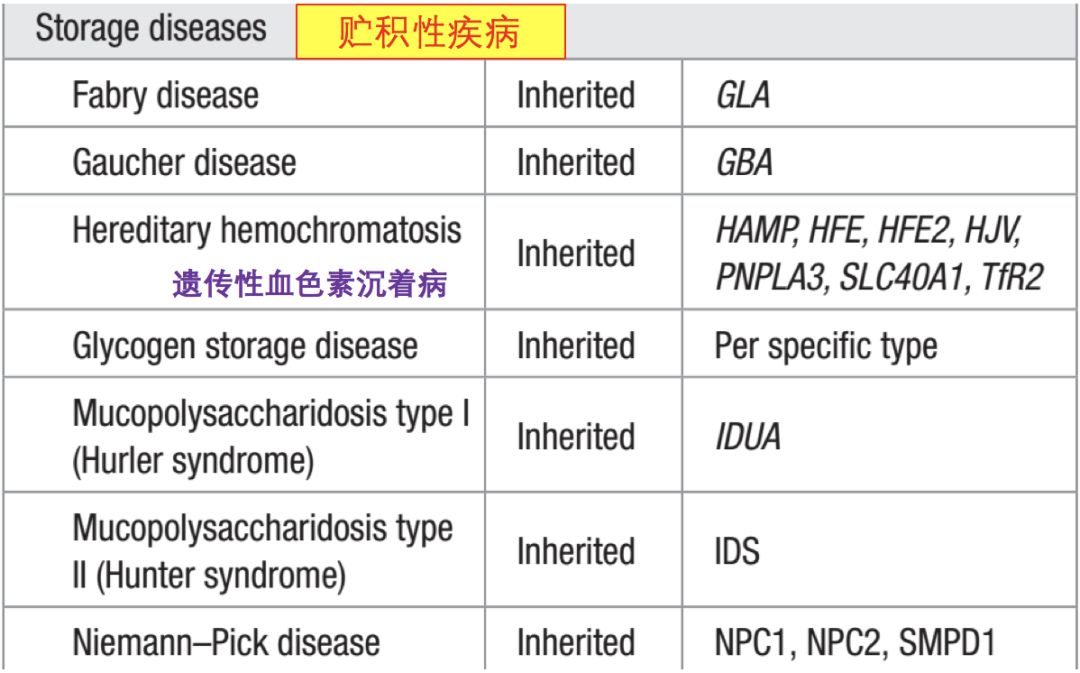
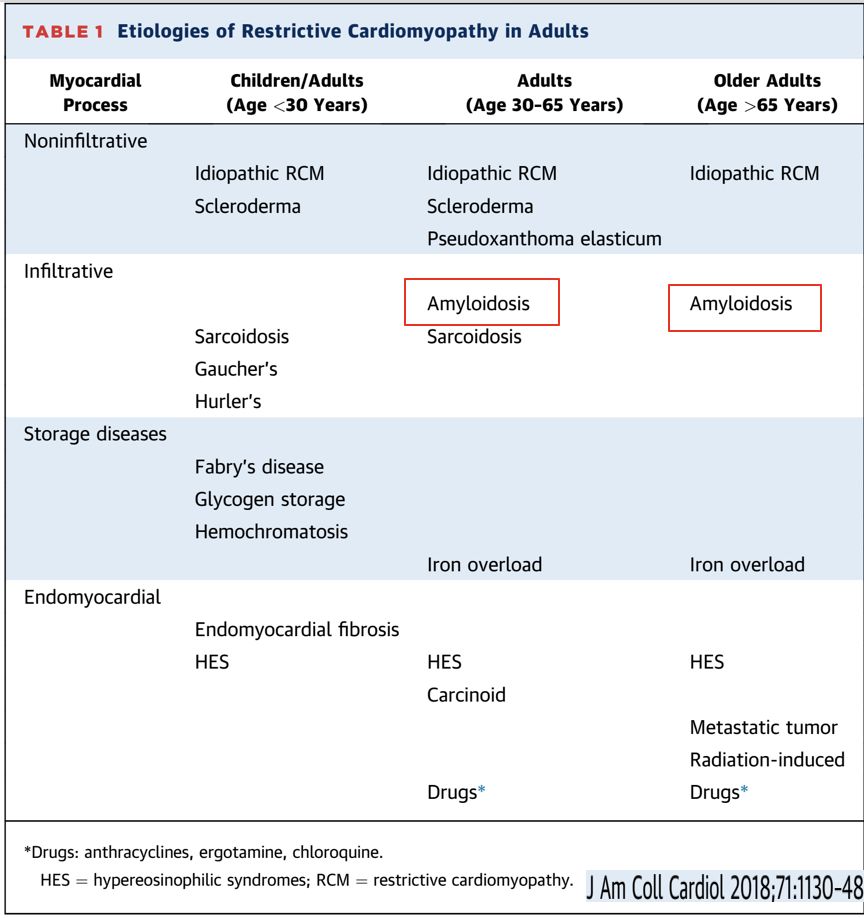
肥厚的限制型心肌病(90%?)
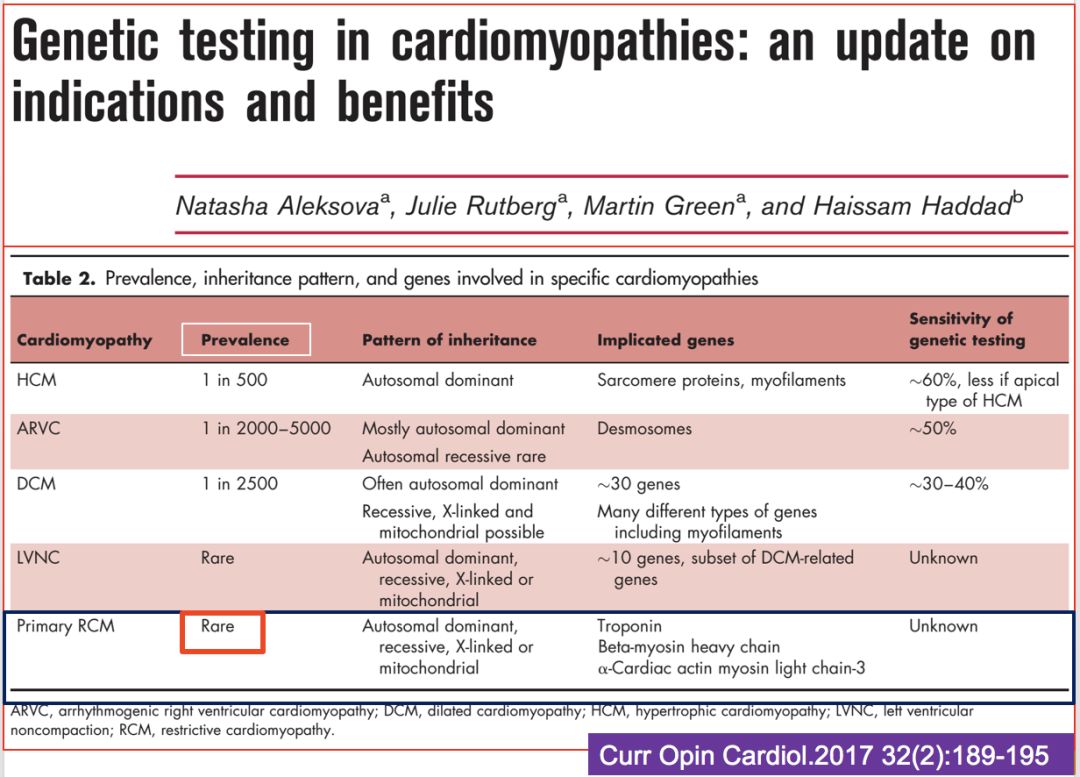
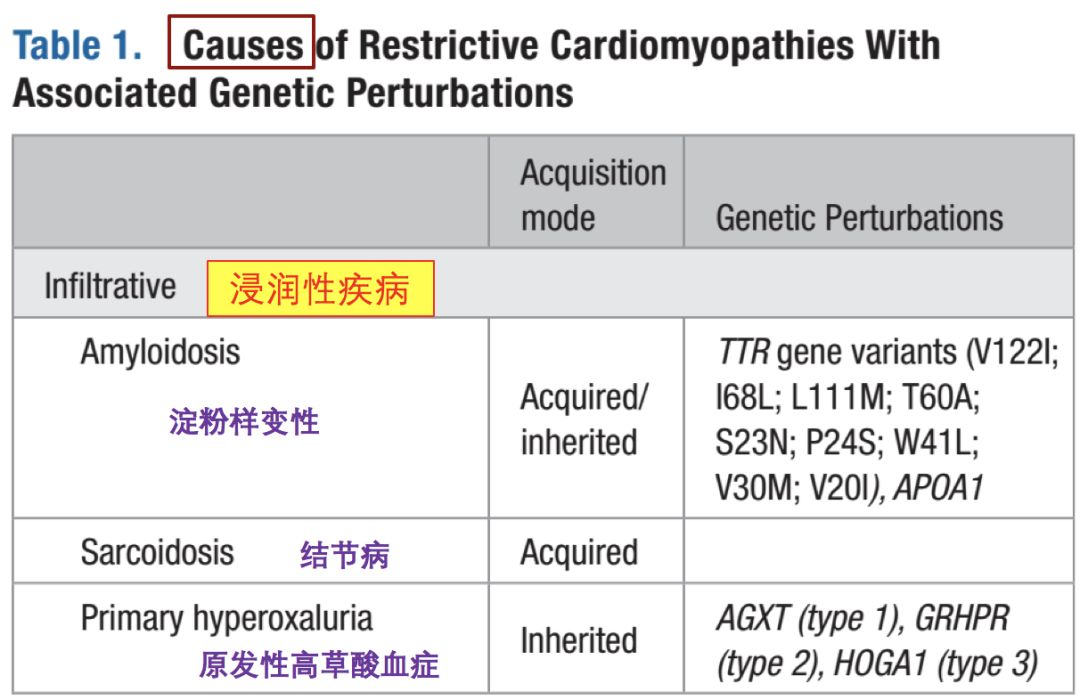
• 心脏淀粉样变性(cardiac amyloidosis,CA)
• 心脏结节病(cardiac sarcoidosis,CS)
• 心脏血色素病(cardiac hemochromatosis,CH)
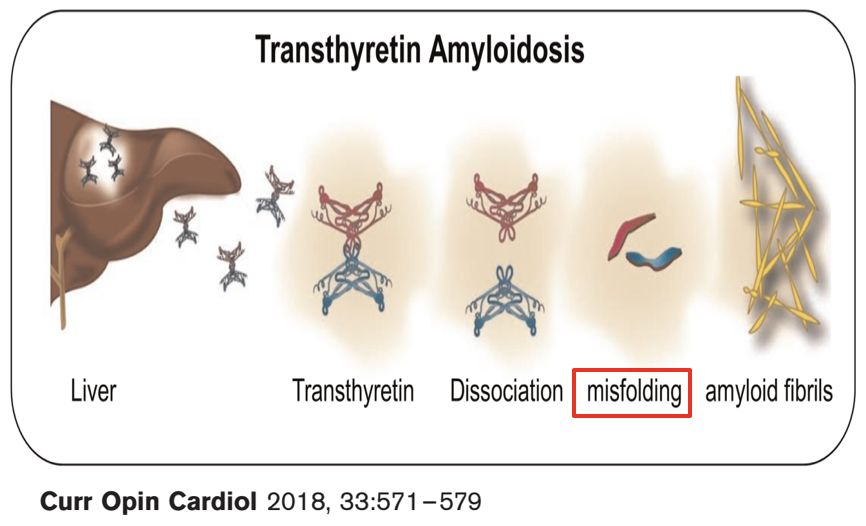
• 早在1854年,Virchow发现人体组织细胞间有一种沉淀物,与碘接触后呈现类似淀粉(amylum或starch)的颜色反应,他称其为淀粉样物质(amyloid)(误认为是粘多糖,polysaccharide),这种沉积现象即为淀粉样变性(amyloid degeneration)(amyloidosis)
• 所谓淀粉样物质,实为由不同成分组成的蛋白质,故称其为淀粉样蛋白(amyloid protein)更合适
淀粉样变性本质上是一种蛋白质代谢异常疾病

• Amyloidosis is a syndrome characterized by the extracellular deposition of a misfolded protein as amyloid, leading to organ functional loss.
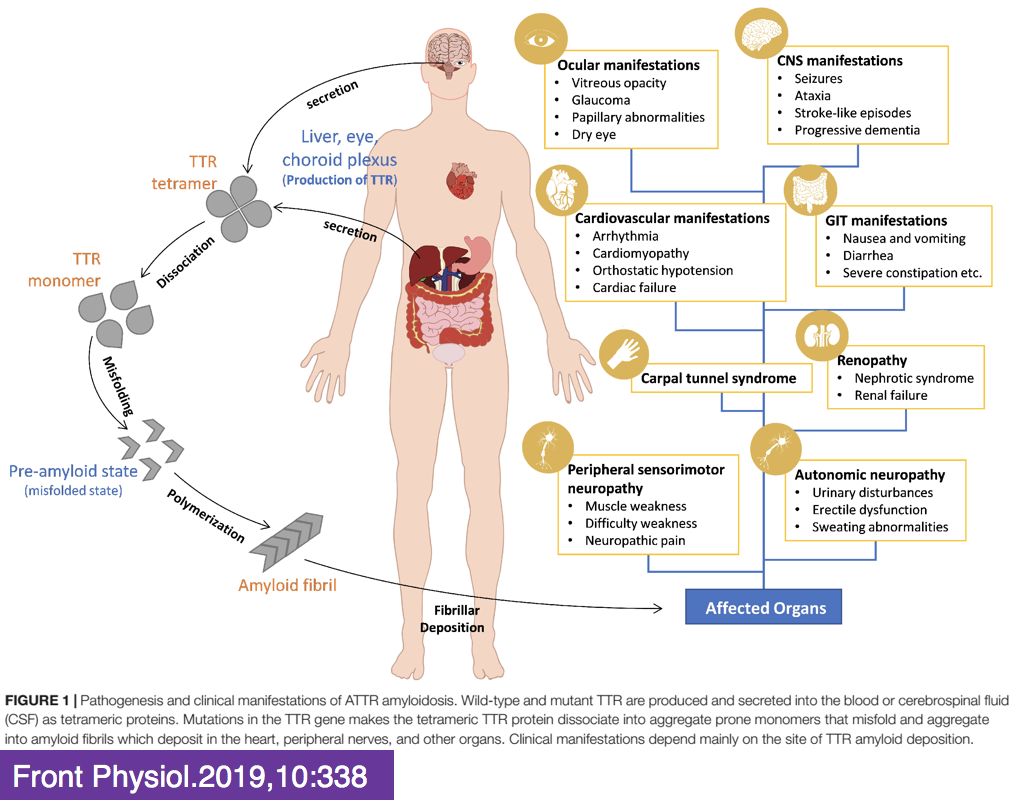
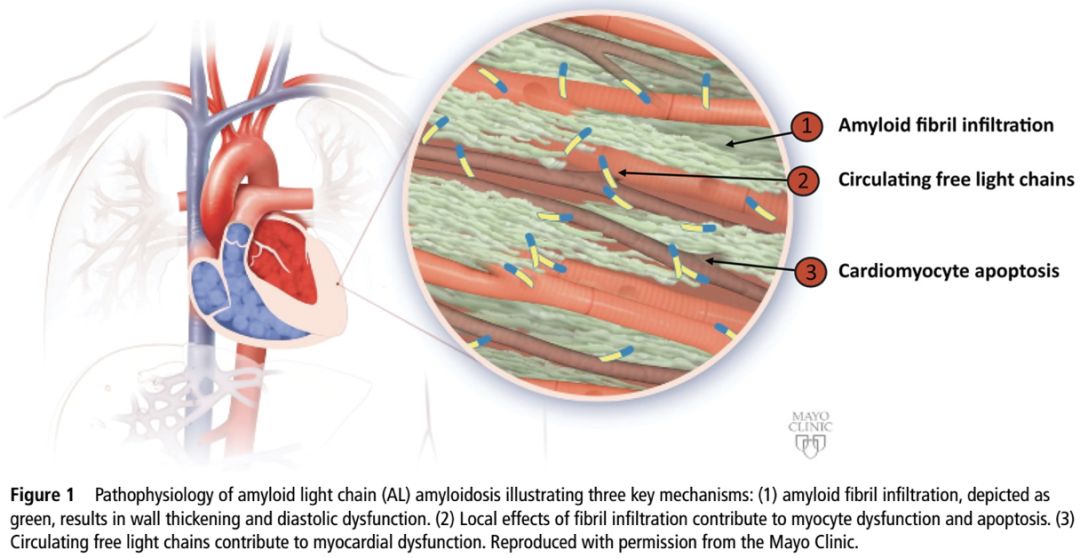
• Amyloid deposition in the heart (cardiac amyloidosis)leads to cardiomyocyte separation, cellular toxicity, apoptosis, and tissue stiffness.
• Amyloid deposits are insoluble and accumulate continuously, leading to heart failure from mechanical, biochemical, and electric dysfunction.
• 目前已识别出30多种致淀粉样变蛋白质(amyloidogenic proteins)
— 免疫球蛋白轻链(light chain immunoglobulin)
— 野生型转甲状腺素蛋白(wild-type transthyretin, TTRwt)
— 突变型转甲状腺素蛋白(mutant transthyretin, TTRm)
➤ 心脏淀粉样变性的类型命名
• Current nomenclature uses “A” for amyloid followed by “X” to denote the precursor protein from which the fibrils are derived.
• Thus, immunoglobulin light chain amyloid is termed “AL” and transthyretin amyloid is “ATTR.”
➤ AL型心脏淀粉样变性
• 因浆细胞病(plasma cell dyscrasia)导致免疫球蛋白轻链产生过多,伴或不伴多发性骨髓瘤
• 虽多器官受累常见(如肝脏、肾脏、消化道、神经系统和软组织等),但大约5%的病人仅心脏受累
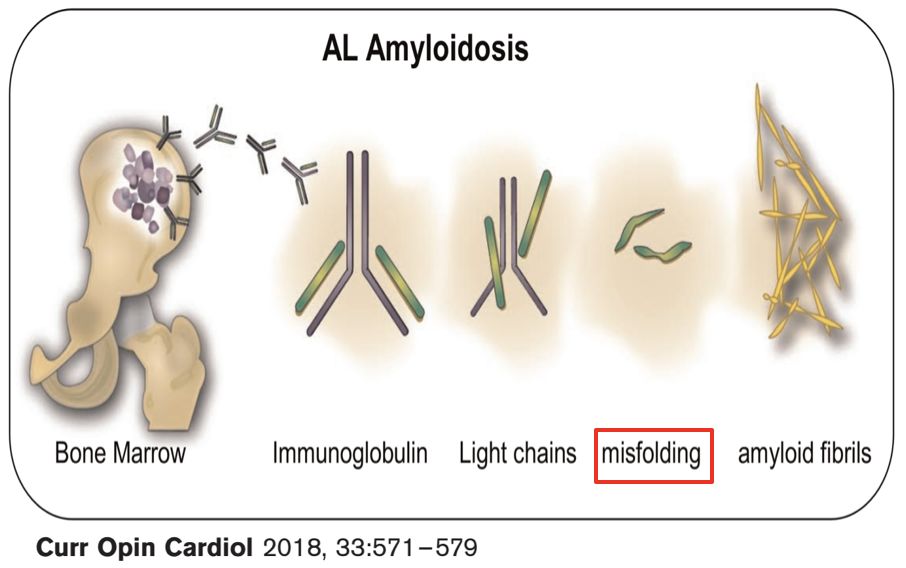
• 但心脏淀粉样变性不是一个单纯的浸润性心肌病,异常前体蛋白及其他循环因子的直接毒性可引起心肌功能不全
• 动物模型研究显示致淀粉样变轻链可增加活性氧 (reactive oxygen species)的产生,导致心肌收缩和舒张功能受损
• 循环的游离轻链具有直接“毒性”作用,可部分解释有些患者尽管心肌仅轻-中度增厚,但症状严重
➤ ATTRwt型心脏淀粉样变性
• 转甲状腺素蛋白(transthyretin,TTR):主要由肝脏产生,为甲状腺素的转运蛋白及视黄醇结合蛋白。
• TTR需呈四聚体(tetramer)才能发挥作用,但其本身容易分解成单体(monomer),后者具有致淀粉样变的特性
• ATTRwt既往也称为老年性CA,目前发现40岁即有发病者
➤ ATTRm型心脏淀粉样变性
• TTR基因发生点突变,导致单个氨基酸置换,使TTR四聚体解离呈单体的可能性增加,从而引起淀粉样物质沉积
• 迄今发现超过130个的突变位点,V30M (在位点30缬氨酸被蛋氨酸取代) 、V122I 、T60A相对常见
• Firstly, the protein may have an intrinsic propensity to misfold and deposit throughout one's lifetime as part of the aging process or when present in abnormally high concentrations.
• Secondly,the gene encoding for the protein may be altered, rendering it more likely to misfold. Like many genetic conditions, this can be inherited or occur sporadically/de novo.
• Thirdly, the precursor protein may undergo abnormal proteolytic remodeling resulting in a conformation that is more likely to misfold.
• Fourthly, some proteins (such as Pmel 17) that occur in nature appear to form amyloid normally.
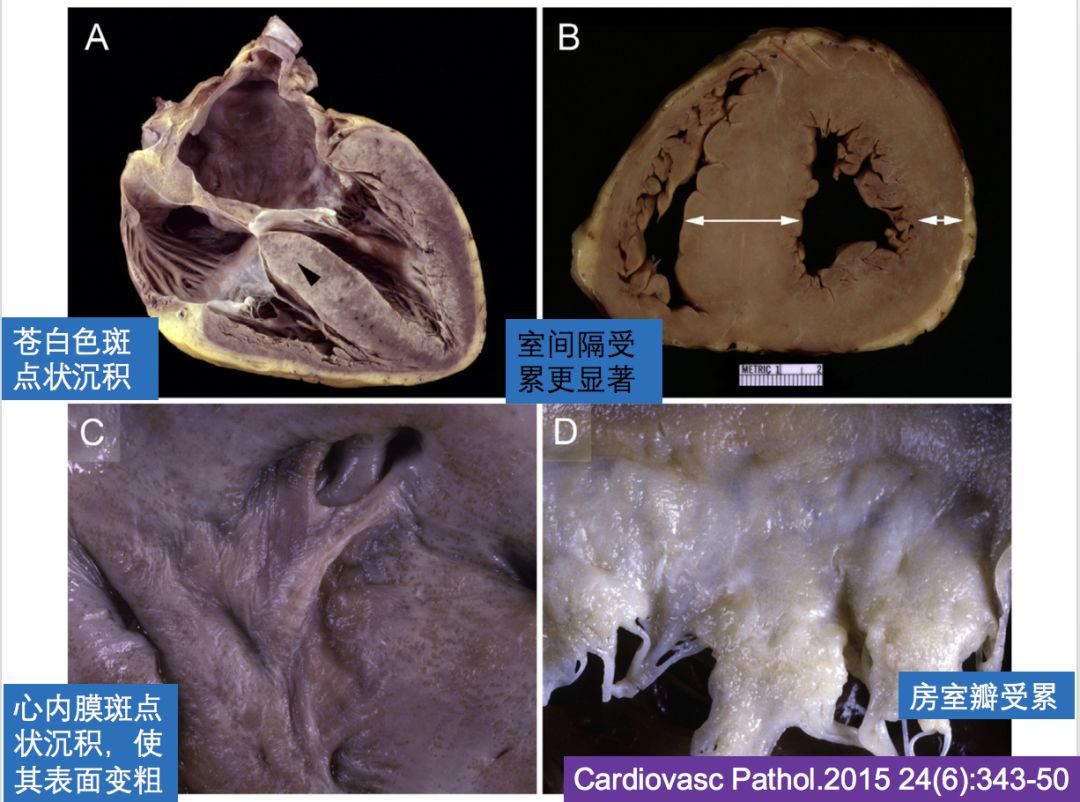
Cardiovasc Pathol.2015 24(6):343-50
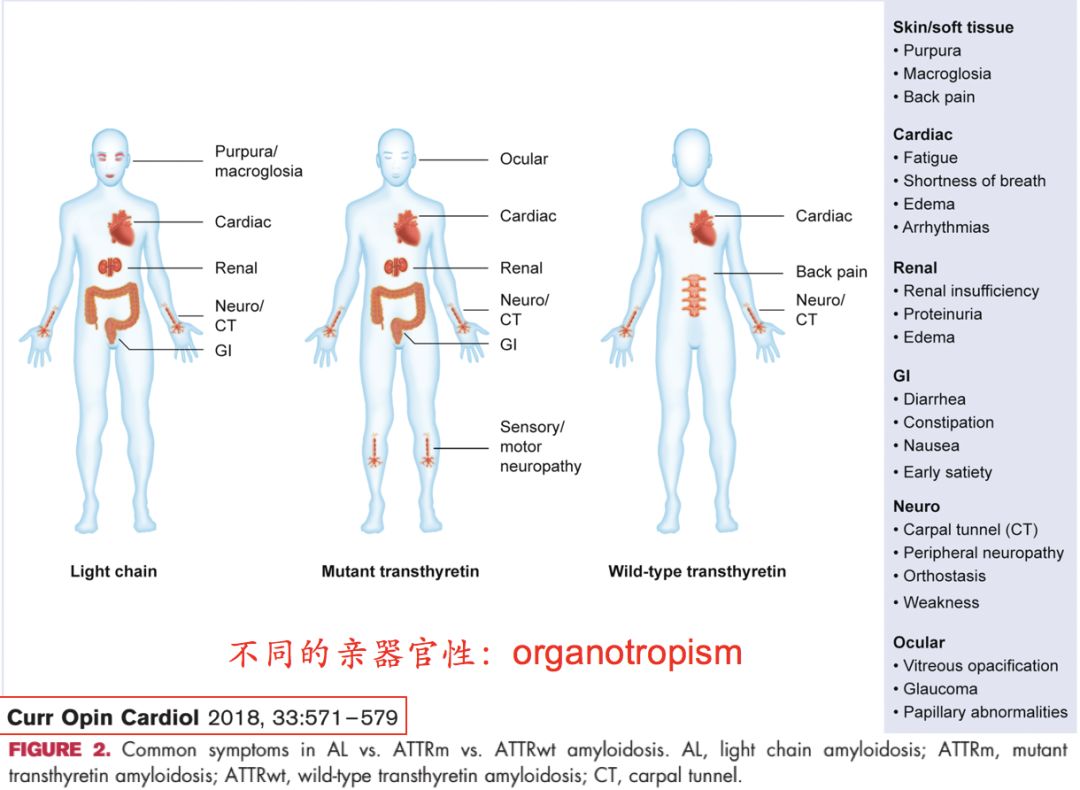
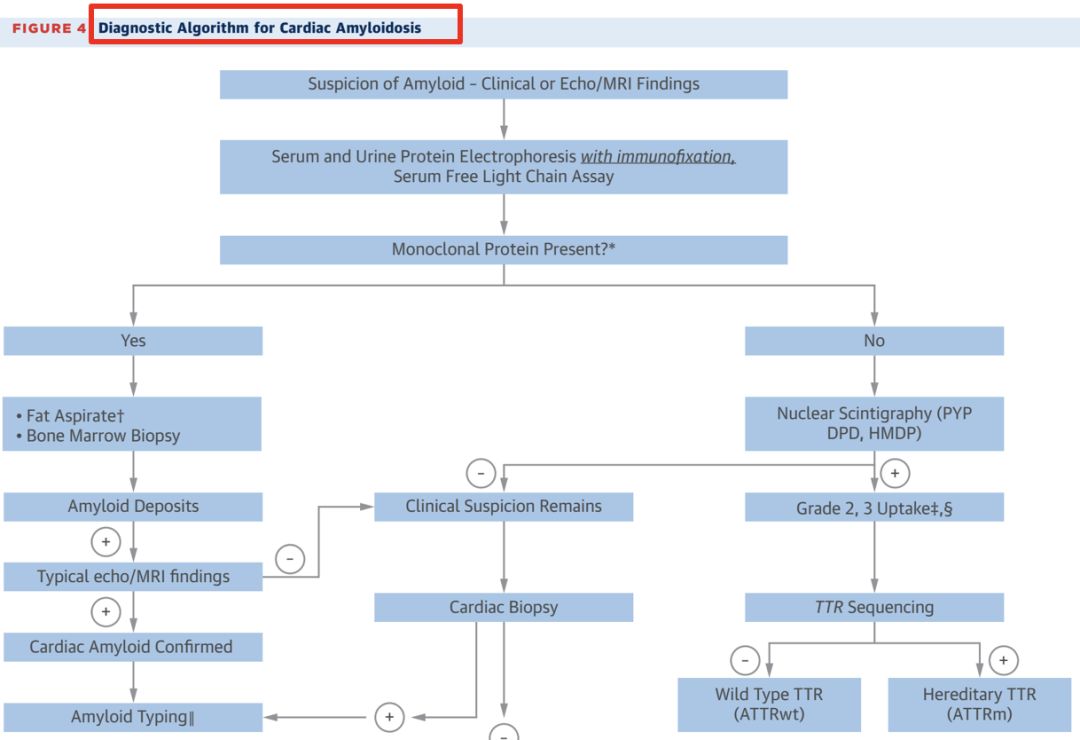
• 心脏淀粉样变性有三种常见类型:AL、ATTRwt和ATTRm

陈良华教授
山东省立医院
主任医师,教授,现为山东大学附属省立医院主任医师,心内科副主任。兼任山东省心血管病分会委员、山东省医师协会心律失常专业委员会副主任委员、山东省心电生理与起搏分会副主任委员、中国医师协会心血管内科医师分会心律失常专业委员会委员、中华医学会心电生理与起搏分会无创心电学组委员、中国医促会心律与心电分会委员等。目前主要从事心律失常的导管消融和冠心病的介入治疗。已发表文章70余篇,参编专著6部,获山东省科学技术进步奖三等奖一项。