


在2016年中国国际心力衰竭大会暨中国医师协会心力衰竭专业委员会第一届学术年会上,来自北京协和医院的陈未教授给我们带来了“病例报告”精彩报告。

入院情况
男,54岁,出租车司机。
反复发热、喘憋、突发意识丧失。
现病史
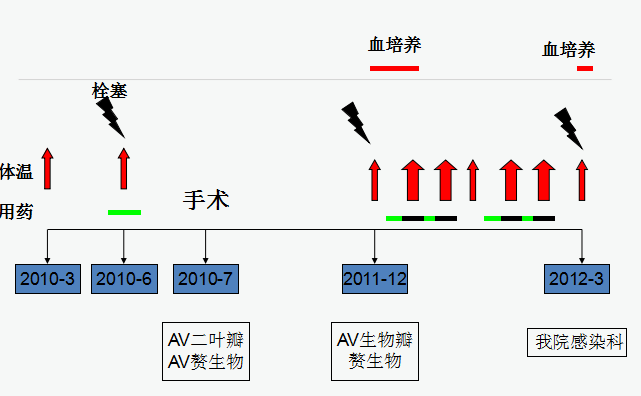
2010年3月起间断发热,Tmax38°C,无寒战。
2010年6月突发左半身活动不利,言语不清、双侧口角流涎,伴发热,T 38-39°C,诊为“脑梗”,予静脉抗生素、激素,当天言语、活动好转,体温10天后降至正常。
2010年7月夜间发作性胸闷,活动耐量降低,仅可爬楼3层。
外院查血常规:
WBC 7.31×109/L,
N 3.96×109/L。
肝肾功正常。
血培养×2次(-)。
RF:1320 Iu/ml↑,ANA(-)。
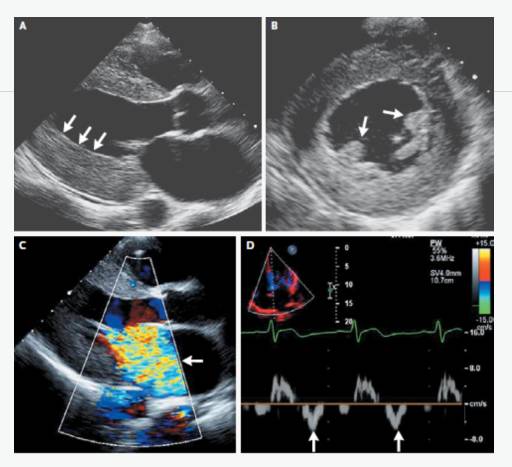
UCG示“先天性主动脉瓣发育不良,主动脉瓣二叶瓣,主动脉瓣狭窄伴轻度关闭不全,主动脉瓣赘生物形成,左心轻大,心功能正常”。
诊断“感染性心内膜炎”。
2010年7月23日行主动脉瓣病灶清除、主动脉瓣生物瓣置换术,术中见“主动脉瓣二叶瓣,主动脉瓣叶赘生物,主动脉瓣增厚、质硬、狭窄伴关闭不全”。
未行组织培养,体温正常,未服抗生素。
ECHO:瓣膜赘生物。
主动脉瓣二叶瓣畸形:
发热。
动脉栓塞。
免疫现象。
2011年5月再次发热,38℃,服阿奇霉素1次,2天后体温正常
2011年12月发热伴寒战, Tmax38.9℃,伴近期记忆损害及言语不利、口角流涎、双膝酸痛
查血常规正常;血培养×5次均(-)
UCG示“主动脉瓣位生物瓣瓣架表面赘生物形成”,考虑“感染性心内膜炎”。
予泰能、青霉素交替,泰能后1-2天体温正常,更换青霉素后低热,不超过38°C,疗程:37天。
UCG“赘生物消失”,但停抗生素1周后再次发热伴寒战Tmax38.6℃UCG “主动脉瓣赘生物”。
2012年3月2日高热,Tmax39℃,伴寒战、双膝酸痛、右眼颞侧一过性偏盲,遂来我院门诊就诊,予口服大扶康1.5g qd、米诺环素50mg bid,5天后体温正常,总疗程8周,仍反复发热,Tmax39.4℃。为进一步诊治入院。
病程中一般情况好,无皮下结节、皮疹及瘀斑、指端坏疽、腹痛、腰痛等。
既往史
(-)
家族史
(-)
入院查体
BP:103/60mmHg,全身皮肤粘膜未见瘀斑、皮肤结节。浅表淋巴结不大。粗测右眼颞侧上部视野缺损。颈软,胸部正中手术瘢痕。双肺未及罗音。
心界不大,心率100次/分,律齐,心尖部可及3/6级收缩期吹风样杂音、2/6级舒张期叹气样杂音,主动脉第1、2听诊区可及3/6级吹风样杂音;三尖瓣听诊区可及3/6级收缩期吹风样杂音。
腹平软,无压痛、反跳痛。肝脾肋下未及。四肢关节无红肿、压痛。双下肢无水肿
眼科:眼底未见Roth斑。视野:右眼颞侧象限盲,左眼鼻侧象限盲
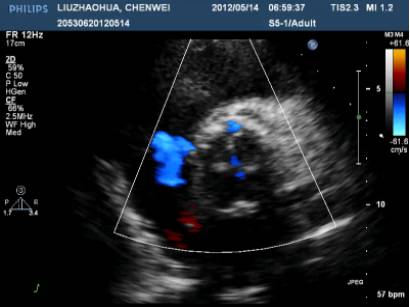
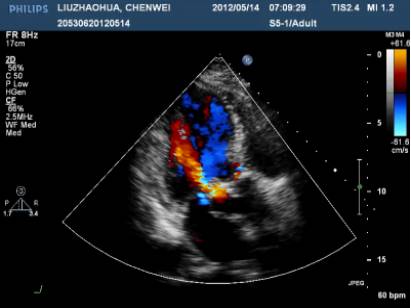
ECHO:
诊断
1977年Pelletier 和Petersdorf 提出最早的IE 诊断--手术或尸检取出的组织病理检查,特异性高,敏感性低。
1981年Von Reyn标准。
1994年Duke标准及2000年修订标准纳入ECHO。


慢性Q热;
亚急性感染性心内膜炎;
先天性主动脉瓣二叶瓣畸形;
主动脉瓣狭窄伴关闭不全;
主动脉瓣生物瓣换瓣术后;
主动脉瓣生物瓣赘生物;
瓣周漏。
需要解决的问题
病原微生物:
大扶康+米诺环素满8周后停药,停药1周后再次高热,无寒战,48小时内抽取8次血培养,全阴性(血培养全阴性)。
PVE常见微生物:
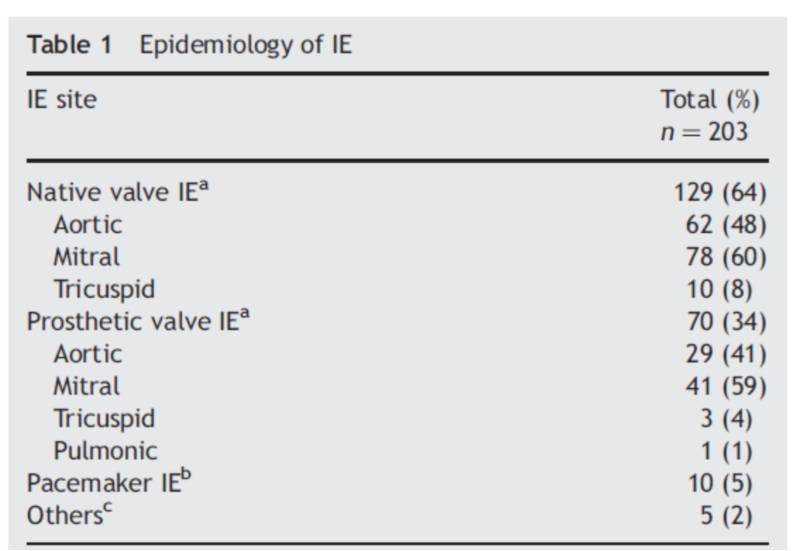
早期(2月内):金葡菌 36%、凝固酶阴性葡萄球菌17%、血培养阴性17%、真菌9%。
晚期(2月后):凝固酶阴性葡萄球菌和S.aureus(各18-20%)、血培养阴性、肠球菌和草绿色链球菌(各10-13%)。
PVE感染时间:
早期:手术中直接污染或术后血行播散、尚未内皮化、纤维连接蛋白和纤维蛋白原。
晚期: 类似于NVE。侵袭力弱(除外金葡菌和其它毒力强细菌)、瓣周脓肿少、瓣叶受累多、猪生物瓣退化-血小板纤维蛋白沉积。
IE风险:
术后3个月最高,从术后12个月起每年降低0.4%。发病率第1年1-3%、第5年3-6%。术后第一年主动脉瓣=二尖瓣、机械瓣=生物瓣;术后18月机械瓣<生物瓣。
多次血培养仍阴性,下一步抗生素选择及疗程:
血培养阴性的IE定义:三次独立的血培养,培养7天均为阴性,约2%-7%。
主要原因:已使用抗生素、细菌室技术限制、苛生菌或非细菌 。


针对性抗生素:
米诺环素:100mg bid;
羟氯喹:0.2g tid。
需用药时间:两年(体温始终正常)。
Q Fever IE危险因素:血培养阴性、瓣膜基础病变、发热(伴或不伴白细胞升高)、免疫缺陷、瓣周漏、多系统受累。
随访第13个月:
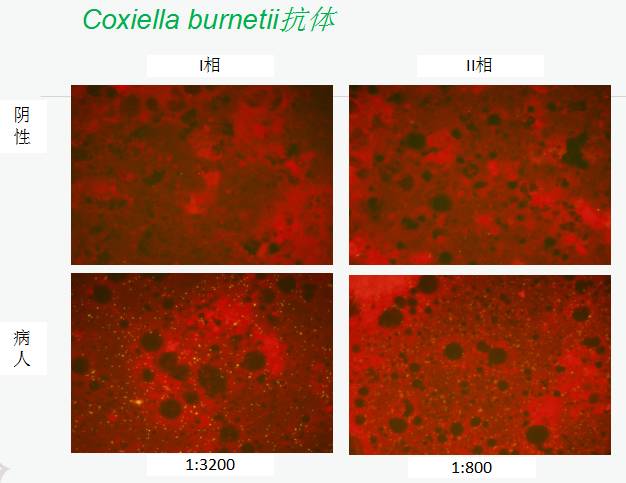
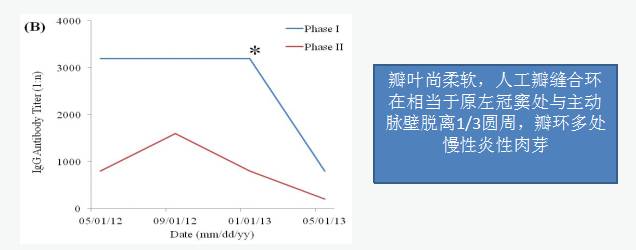
2013年5月,Coxiella burnetii抗体,Phase I IgG 1:3200 、Phase II IgG 1:800,出现平地行走100米喘憋。
UCG示“重度主动脉瓣瓣周漏,主动脉瓣中重度狭窄,各瓣膜未见赘生物”Coxiella burnetii抗体持续升高,提示感染持续存在。
患者出现心衰症状,二次手术指征。
再次手术介入的时机:
主动脉瓣机械瓣置入:术后Coxiella burnetii抗体,Phase I IgG 1:320, Phase II IgG1:100。


原因
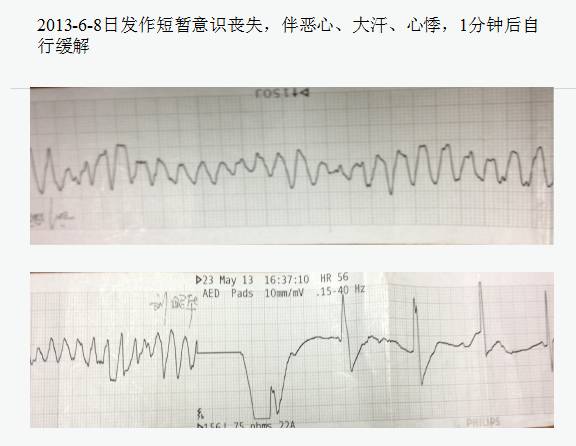
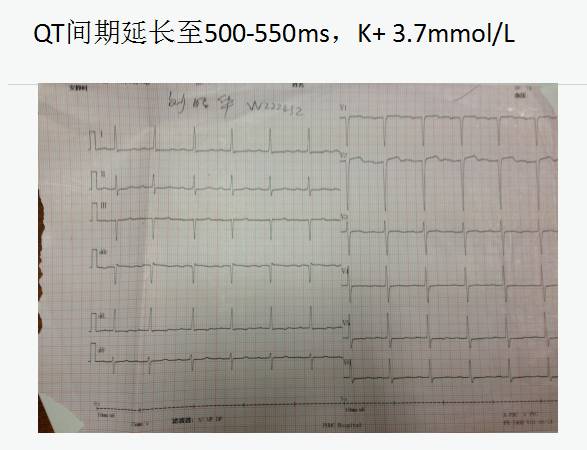
药物:长期服用羟氯喹-Q-T间期延长,心律失常,阿斯综合征,心脏骤停。
心肌损伤:手术后。
低钾。
停用羟氯喹,改米诺环素
羟氯喹:
作为一种抗疟药和免疫调节药常用于治疗疟疾、少见的病原如立克次体感染以及结缔组织病等。口服给药后,羟氯喹可以被迅速且完全的吸收,并在不同组织中分布,组织浓度最高的是眼、皮肤、骨骼肌、肝肾肺和心肌,其半衰期长达20-60天,经过肝脏和肾脏排泄。
长期使用羟氯喹会产生多脏器损害,常见为视网膜病变、神经系统病变、皮肤色素沉着等,近年来对于心肌的损伤报道增多。
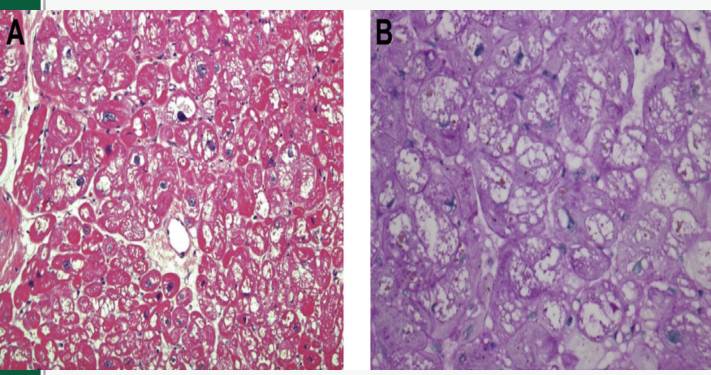
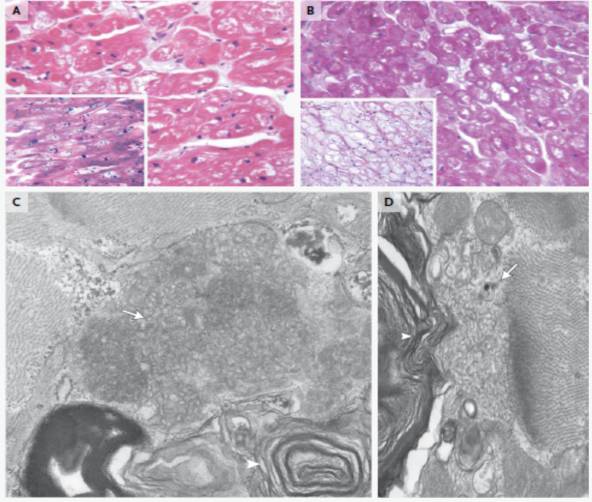
病理:羟氯喹可以直接抑制溶酶体内的磷脂,改变溶酶体内PH环境,降低溶酶体酶活性,导致溶酶体储存障碍,引起代谢物质在心肌细胞和传导细胞中的蓄积。病理上典型表现为心肌细胞浆内空泡形成,肌丝紊乱,细胞肥大和心肌细胞纤维化。
羟氯喹导致的心肌损伤:
(1)传导系统:出现束支阻滞、III度房室传导阻滞,Q-T间期延长及尖端扭转性室速。
(2)心肌病变:如心室肌向心性肥厚、限制样舒张功能减低、双房增大等。
(3)其它:少见损伤如肺高压。
鉴别诊断:除外浸润性/储积性疾病如Fabry病、Danon病、淀粉样变性等。
羟氯喹心脏毒性的危险因素:
高龄、女性、用药时间超过10年,每日用药剂量大、基础的心脏疾病以及肾功能不全等。
基础心脏疾病有高血压、全身感染、糖尿病和免疫病等,都可能增加羟氯喹心脏损伤的风险。
羟氯喹用药时程心肌毒性的发生时间多见于羟氯喹平均用药10年左右,个体差异,也可见于用药后3个月和30年,发生心衰的羟氯喹累积剂量为270g-9125g
本例患者羟氯喹累积用量为219g。
疾病本身 vs 药物引起的心脏损伤:
心肌病变常被低估,持续用药可能导致预后不佳,如出现顽固心衰、恶性心律失常、死亡,一旦意识到药物的因素,早期停药,心脏受累则是可逆的。

随访
一直无发热;
正常活动;
仍服用米诺环素;
Phase I IgG 1:800, Phase II IgG1:200。